Hvilke har det højeste kogepunkt MGO og CAO eller NaCl HCL CO2 SO2?
Faktorer, der påvirker kogepunktet:
* Intermolekylære kræfter: Jo stærkere tiltrækningskræfter mellem molekyler, jo mere energi er nødvendig for at overvinde dem og forårsage en tilstandsændring fra væske til gas.
* ionisk vs. kovalent binding: Ioniske forbindelser har generelt højere kogepunkter end kovalente forbindelser, fordi den elektrostatiske tiltrækning mellem modsat ladede ioner er meget stærk.
* molekylær størrelse og masse: Større molekyler med højere molekylvægte har flere elektroner og et større overfladeareal til intermolekylære interaktioner, hvilket fører til højere kogepunkter.
* Polaritet: Polære molekyler har stærkere intermolekylære kræfter (dipol-dipolinteraktioner) end ikke-polære molekyler.
Sammenligning af forbindelserne:
* mgo og Cao: Begge er ioniske forbindelser. De har meget høje kogepunkter på grund af de stærke ioniske bindinger mellem metalkationerne og oxidanioner. CAO har et lidt højere kogepunkt end MgO, fordi calcium er større end magnesium, hvilket fører til svagere ioniske bindinger i MgO.
* NaCl: En anden ionisk forbindelse med et meget højt kogepunkt på grund af de stærke ioniske bindinger mellem natrium- og chloridioner.
* hcl: En kovalent forbindelse med et meget lavere kogepunkt end de ioniske forbindelser ovenfor. Dipol-dipolkræfterne mellem HCL-molekyler er svagere end ioniske bindinger.
* CO2: Et ikke -polært kovalent molekyle med et meget lavt kogepunkt. De eneste tilstedeværende intermolekylære kræfter er svage London -spredningskræfter.
* SO2: Et polært kovalent molekyle med et moderat kogepunkt. Det har dipol-dipolstyrker, som er stærkere end London-spredningskræfter.
Derfor er forbindelserne med de højeste kogepunkter:
1. mgo og Cao (ioniske, stærke bindinger)
2. naCl (ioniske, stærke bindinger)
Ordenen fra det højeste til laveste kogepunkt ville være:
1. Mgo / Cao
2. NaCl
3. SO2
4. HCL
5. CO2
Sidste artikelHvor mange atomer er der i 2,5 mol brint?
Næste artikelHvilket mønster i natriumchlorid er de ioner, der er oprettet?
 Varme artikler
Varme artikler
-
 Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik
Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik -
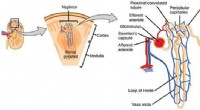 Enhed til at fremskynde opdagelse af lægemidler til nyresygdommeKredit:CNX OpenStax Forskere fra Institut for Ingeniørvidenskab samarbejder med industrien og den akademiske verden om at udvikle et apparat til at forbedre testningen af lægemidler til nyresygd
Enhed til at fremskynde opdagelse af lægemidler til nyresygdommeKredit:CNX OpenStax Forskere fra Institut for Ingeniørvidenskab samarbejder med industrien og den akademiske verden om at udvikle et apparat til at forbedre testningen af lægemidler til nyresygd -
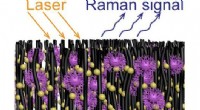 En hurtig og billig enhed til at fange og identificere viraArray af nanorør dekoreret med guld nanopartikler fanger virusmolekyler. Kredit:Terrones Lab/Penn State En enhed til hurtigt at fange og identificere forskellige virusstammer er blevet udviklet, i
En hurtig og billig enhed til at fange og identificere viraArray af nanorør dekoreret med guld nanopartikler fanger virusmolekyler. Kredit:Terrones Lab/Penn State En enhed til hurtigt at fange og identificere forskellige virusstammer er blevet udviklet, i -
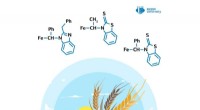 Kemiker skaber stoffer, der stimulerer plantevækstKredit:RUDN Universitet En kemiker fra RUDN University har opnået biologisk aktive derivater af ferrocen, som stimulerer plantevæksten med 67 % og beskytter dem mod herbicider. Artiklen blev publi
Kemiker skaber stoffer, der stimulerer plantevækstKredit:RUDN Universitet En kemiker fra RUDN University har opnået biologisk aktive derivater af ferrocen, som stimulerer plantevæksten med 67 % og beskytter dem mod herbicider. Artiklen blev publi


