Hvilke bindinger er de sidste, der går i stykker, når et enzym opvarmes 1 disulfid 2 hydrogen 3 hydrofobe interaktioner 4 ionisk?
* Disulfidbindinger er den stærkeste type binding involveret i proteinstruktur. De er kovalente bindinger dannet mellem svovlatomer i cysteinrester. Disse obligationer er meget stabile og kræver betydelig energi for at bryde.
* Hydrogenbindinger er svagere end disulfidbindinger, men stadig vigtige for proteinstruktur. De danner mellem polære grupper inden for proteinet.
* Hydrofobe interaktioner er den svageste type binding involveret i proteinstruktur. De stammer fra tendensen fra ikke -polære sidekæder til at klynge sig sammen og undgå kontakt med vand.
* ioniske bindinger er stærkere end hydrofobe interaktioner, men svagere end hydrogenbindinger. De danner mellem modsat ladede aminosyresidekæder.
Kortfattet:
Når et enzym opvarmes, bryder de svageste bindinger (hydrofobe interaktioner) først. Når temperaturen stiger, bryder brintbindinger og ioniske bindinger, og til sidst bryder de stærkeste bindinger (disulfidbindinger). Denne proces kaldes denaturering , hvor enzymet mister sin tredimensionelle struktur og dens funktion.
Sidste artikelHvor mange atomer udgør carbonation?
Næste artikelEr natriumchlorid det samme som Guar Hydroxypropyltrimoniumchlorid?
 Varme artikler
Varme artikler
-
 Supramolekylære materialer med en tidskontaktForskere ved det tekniske universitet München (TUM) har nu med succes udviklet supramolekylære materialer, der går i opløsning på et forudbestemt tidspunkt. Som et eksempel danner disse Fmoc-tripeptid
Supramolekylære materialer med en tidskontaktForskere ved det tekniske universitet München (TUM) har nu med succes udviklet supramolekylære materialer, der går i opløsning på et forudbestemt tidspunkt. Som et eksempel danner disse Fmoc-tripeptid -
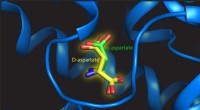 Montering af en højre hånd i en venstrehåndsvanteDenne illustration viser L- og D-aspartat på bindingsstedet for transportproteinet. Kredit:Valentina Arkhipova, University of Groningen Mange biomolekyler findes i to versioner, der er hinandens s
Montering af en højre hånd i en venstrehåndsvanteDenne illustration viser L- og D-aspartat på bindingsstedet for transportproteinet. Kredit:Valentina Arkhipova, University of Groningen Mange biomolekyler findes i to versioner, der er hinandens s -
 Lavpris, energieffektiv tilgang til behandling af vand, der er forurenet med tungmetallerKredit:CC0 Public Domain Ingeniører på MIT har udviklet en ny tilgang til fjernelse af bly eller andre tungmetalforurenende stoffer fra vand, i en proces, som de siger er langt mere energieffektiv
Lavpris, energieffektiv tilgang til behandling af vand, der er forurenet med tungmetallerKredit:CC0 Public Domain Ingeniører på MIT har udviklet en ny tilgang til fjernelse af bly eller andre tungmetalforurenende stoffer fra vand, i en proces, som de siger er langt mere energieffektiv -
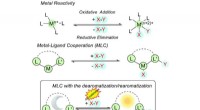 Forståelse af aromaticitet i katalyse for at låse op for nye mulighederFig. 1 Forskellige former for substrataktivering i konventionel og metal-ligand kooperativ katalyse. Kredit: Kemisk kommunikation (2021). DOI:10.1039/D1CC00528F Aromaticitet, et koncept, der norm
Forståelse af aromaticitet i katalyse for at låse op for nye mulighederFig. 1 Forskellige former for substrataktivering i konventionel og metal-ligand kooperativ katalyse. Kredit: Kemisk kommunikation (2021). DOI:10.1039/D1CC00528F Aromaticitet, et koncept, der norm


