Når en syre og alkali reagerer, hvad er pH -værdien?
* stærk syre + stærk base: Reaktionen producerer en neutral opløsning med en ph på 7 . Dette skyldes, at den stærke syre og den stærke base dissocieres fuldstændigt i vand og producerer lige store mængder H+ og OH-ioner, som derefter neutraliserer hinanden.
* stærk syre + svag base: Reaktionen producerer en let sur opløsning med en pH mindre end 7 . Dette skyldes, at den stærke syre vil adskille sig fuldstændigt, mens den svage base kun delvist vil adskille sig. Som et resultat vil der være et overskud af H+ -ioner, hvilket gør opløsningen sur.
* svag syre + stærk base: Reaktionen producerer en lidt grundlæggende opløsning med en ph større end 7 . Dette skyldes, at den stærke base vil adskille sig fuldstændigt, mens den svage syre kun delvist vil adskille sig. Som et resultat vil der være et overskud af ohioner, hvilket gør løsningen grundlæggende.
* svag syre + svag base: Reaktionen vil producere en opløsning med en pH, der afhænger af de relative styrker af syren og basen. Hvis syren er stærkere, vil opløsningen være lidt sur. Hvis basen er stærkere, vil opløsningen være lidt grundlæggende. Hvis de er lige i styrke, vil opløsningen være tæt på neutral.
Eksempel:
* Saltsyre (HCI) er en stærk syre, og natriumhydroxid (NaOH) er en stærk base. Når de reagerer, producerer de vand (H2O) og natriumchlorid (NaCl), som er et neutralt salt. Den resulterende opløsning har en pH på 7.
Vigtig note: Den nøjagtige pH i opløsningen afhænger også af -koncentrationerne af syre og base.
 Varme artikler
Varme artikler
-
 Lagring af data som blandinger af fluorescerende farvestofferBlandinger af fluorescerende farvestofmolekyler, placeret små steder på en epoxyoverflade med en inkjetprinter, kode data. Kredit:American Chemical Society. Efterhånden som verdens behov for datal
Lagring af data som blandinger af fluorescerende farvestofferBlandinger af fluorescerende farvestofmolekyler, placeret små steder på en epoxyoverflade med en inkjetprinter, kode data. Kredit:American Chemical Society. Efterhånden som verdens behov for datal -
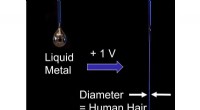 Kontrol af strømme af flydende metal ved stuetemperaturNår flydende metal frigives til vand, dens høje overfladespænding får den til at danne dråber - frem for vandløb. Men når der laves en lav spænding, overfladespændingen falder, tillader det flydende m
Kontrol af strømme af flydende metal ved stuetemperaturNår flydende metal frigives til vand, dens høje overfladespænding får den til at danne dråber - frem for vandløb. Men når der laves en lav spænding, overfladespændingen falder, tillader det flydende m -
 Teamet opdager enzymdomæner, der dramatisk forbedrer ydeevnenEn del af forskergruppen, der opdagede bestemte områder på enzymer, der hjælper med at nedbryde cellulose hurtigere, NREL -videnskabsmand Markus Alahuhta forbereder plader til at opnå proteinkrystalle
Teamet opdager enzymdomæner, der dramatisk forbedrer ydeevnenEn del af forskergruppen, der opdagede bestemte områder på enzymer, der hjælper med at nedbryde cellulose hurtigere, NREL -videnskabsmand Markus Alahuhta forbereder plader til at opnå proteinkrystalle -
 Lad os se væske-væske grænsefladenNogle væsker som olie og vand blandes ikke, men kemiske reaktioner kan forekomme på deres grænse i kemikeres hænder. Prof. Marcin Opałło undersøger de processer, der finder sted på væske-væske interfa
Lad os se væske-væske grænsefladenNogle væsker som olie og vand blandes ikke, men kemiske reaktioner kan forekomme på deres grænse i kemikeres hænder. Prof. Marcin Opałło undersøger de processer, der finder sted på væske-væske interfa
- Hvad er den mest udbredte gas i vores atmosfære oxygen hydrogen nitrogen vand?
- Kigger ind i Little Foots 3,67 millioner år gamle hjerne
- Hvad er et eksempel på en skovbugler?
- Er en reaktion i syrer og baserer en kemisk eller fysisk ændring?
- Hvad er den kortfattede form for at beskrive kemiske reaktioner?
- IKEA og Sonos går sammen om SYMFONISK-højttalere og en lampe


