Forklar, hvorfor en løsning af HCL i benzen ikke udfører elektricitet, men vand det gør?
Forståelse af ledningsevne
* Elektrisk ledningsevne er et stofs evne til at tillade strømmen af elektrisk strøm. Denne strøm opnås ved bevægelse af ladede partikler (ioner).
* elektrolytter er stoffer, der udfører elektricitet, når de opløses i et passende opløsningsmiddel.
HCl i vand
1. dissociation: Når HCL opløses i vand, gennemgår den ionisering (en kemisk reaktion). De polære vandmolekyler trækker HCL -molekylerne fra hinanden og danner hydroniumioner (H₃O⁺) og chloridioner (CL⁻):
`` `
HCL (G) + H₂O (L) → H₃O⁺ (AQ) + CL⁻ (AQ)
`` `
2. Mobilitet af ioner: De frit bevægende H₃O⁺ og Cl⁻ioner i opløsningen kan bære elektrisk strøm. Når der påføres et elektrisk felt, migrerer disse ioner mod de modsatte ladede elektroder, hvilket muliggør strøm af elektricitet.
HCl i benzen
1. ikke-polær opløsningsmiddel: Benzen (C₆H₆) er et ikke-polært opløsningsmiddel. Det har ikke noget stærkt dipolmoment at tiltrække og trække HCL -molekylerne fra hinanden.
2. Ingen ionisering: Uden påvirkning af et polært opløsningsmiddel forbliver HCL -molekyler intakte i benzen. De danner ikke ioner.
3. Ingen frie ioner: Da der ikke er nogen frie ioner til stede, er der ingen ladede partikler til at bære en elektrisk strøm. Derfor udfører løsningen ikke elektricitet.
Kortfattet
HCL's evne til at udføre elektricitet afhænger helt af dens evne til at danne ioner i opløsning. Vand, der er et polært opløsningsmiddel, fremmer ionisering af HCI, hvilket gør det muligt for det at udføre elektricitet. Benzen, der er ikke-polær, fremmer ikke ionisering, så opløsningen forbliver ikke-ledig.
 Varme artikler
Varme artikler
-
 Forskere finder potentielle sygdomsbekæmpende sprænghoveder gemt i bakterierDyrkning af en thiocarboxylsyre producerende stamme af bakterier. Kredit:Shen Lab / The Scripps Research Institute Bakterier fundet i jord kan indeholde en potentiel game-changer for lægemiddeldes
Forskere finder potentielle sygdomsbekæmpende sprænghoveder gemt i bakterierDyrkning af en thiocarboxylsyre producerende stamme af bakterier. Kredit:Shen Lab / The Scripps Research Institute Bakterier fundet i jord kan indeholde en potentiel game-changer for lægemiddeldes -
 Ny indsigt i nanokrystalvækst i væskeGlimmer mineralet flager af i fine plader. Kredit:Wikimedia Commons Mange muslingeskaller, mineraler, og halvleder nanomaterialer er opbygget af mindre krystaller, som er samlet som brikkerne i et
Ny indsigt i nanokrystalvækst i væskeGlimmer mineralet flager af i fine plader. Kredit:Wikimedia Commons Mange muslingeskaller, mineraler, og halvleder nanomaterialer er opbygget af mindre krystaller, som er samlet som brikkerne i et -
 Atomisk opfattelse af naturens fantastiske molekylære maskiner på arbejdeMetoden hit and return (HARE) forenkler optagelse af snapshot-film af biomolekyler på arbejdet. Kredit:J. M. Harms, MPSD Forskere fra MPSDs Institut for Atomically Resolved Dynamics ved Center for
Atomisk opfattelse af naturens fantastiske molekylære maskiner på arbejdeMetoden hit and return (HARE) forenkler optagelse af snapshot-film af biomolekyler på arbejdet. Kredit:J. M. Harms, MPSD Forskere fra MPSDs Institut for Atomically Resolved Dynamics ved Center for -
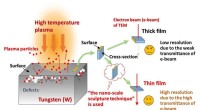 Fusionsforskere har udviklet en skulpturteknik i nanoskalaSkematisk visning af interaktionen mellem plasma og wolfram (til venstre) og forklaring af nødvendigheden af tyndfilmsprøver og den nanoskala skulpturteknik til TEM-observation (højre). Kredit:NIFS
Fusionsforskere har udviklet en skulpturteknik i nanoskalaSkematisk visning af interaktionen mellem plasma og wolfram (til venstre) og forklaring af nødvendigheden af tyndfilmsprøver og den nanoskala skulpturteknik til TEM-observation (højre). Kredit:NIFS
- Skal du spise det? Undersøgelse afslører hundeafføring er en væsentlig del af ræves kost
- Helt ny fysik i superledende metaller, der er tilbagevist af Lancaster -fysikere
- Billede:Japansk skærgård og det vestlige Stillehav
- Hvad bryder sukker ned for at producere celler energi?
- Gel Electrophoresis Lab Procedures
- Hvorfor har partiklerne i havvand mindre energi end damp?


