Hvilken slags intermolekylær binding har nitrogengas?
Her er hvorfor:
* ikke -polær: Kvælstofgas er et diatomisk molekyle med en symmetrisk struktur. Dette gør det ikke -polært, hvilket betyder, at det ikke har noget permanent dipolmoment.
* svag, midlertidig dipol: Mens nitrogengas ikke har nogen permanent dipol, kan der dannes midlertidige dipoler på grund af den tilfældige bevægelse af elektroner. Disse midlertidige dipoler inducerer lignende dipoler i nærliggende molekyler, hvilket skaber en svag attraktiv kraft.
* ldf: Disse midlertidige, svingende dipoler og deres inducerede kolleger er ansvarlige for London -spredningsstyrkerne.
Vigtig note: LDF'er er den svageste type intermolekylær kraft. Dette er grunden til, at kvælstofgas har et meget lavt kogepunkt (-196 ° C).
 Varme artikler
Varme artikler
-
 Slukningspulver genbrugt i gødning og brandhæmmereKredit:ProPHOS Chemicals Et EU-finansieret projekt har genanvendt fosfat fra opbrugt slukningspulver til fremstilling af gødning til landbruget og flammehæmmere til træsektoren. Det italiensk-bas
Slukningspulver genbrugt i gødning og brandhæmmereKredit:ProPHOS Chemicals Et EU-finansieret projekt har genanvendt fosfat fra opbrugt slukningspulver til fremstilling af gødning til landbruget og flammehæmmere til træsektoren. Det italiensk-bas -
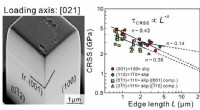 Mikrosøjlekompression til at finde varmetolerante legeringerForskerne målte den plastiske deformation, der skete, da en lille sonde udøvede kraft på mikrosøjleprøverne med forskellige belastningsakseorienteringer. Kredit:National Institute for Materials Scienc
Mikrosøjlekompression til at finde varmetolerante legeringerForskerne målte den plastiske deformation, der skete, da en lille sonde udøvede kraft på mikrosøjleprøverne med forskellige belastningsakseorienteringer. Kredit:National Institute for Materials Scienc -
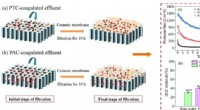 Polytitaniumchlorid-forkoagulering til tilsmudsningskontrol af keramisk membranKredit:Xiaoman Liu et al. Membranteknologi anvendes i vid udstrækning i vandbehandling til fjernelse af suspenderede partikler, kolloider og organiske forurenende stoffer fra forurenet vand. Som en
Polytitaniumchlorid-forkoagulering til tilsmudsningskontrol af keramisk membranKredit:Xiaoman Liu et al. Membranteknologi anvendes i vid udstrækning i vandbehandling til fjernelse af suspenderede partikler, kolloider og organiske forurenende stoffer fra forurenet vand. Som en -
 Højtemperaturenheder fremstillet af film, der bøjer, når de trækker vejret”Det mest interessante ved disse materialer er, at de fungerer ved temperaturer over 500 grader Celsius, ”Siger MIT -kandidatstuderende Jessica Swallow, afbildet med det udstyr, der bruges til at test
Højtemperaturenheder fremstillet af film, der bøjer, når de trækker vejret”Det mest interessante ved disse materialer er, at de fungerer ved temperaturer over 500 grader Celsius, ”Siger MIT -kandidatstuderende Jessica Swallow, afbildet med det udstyr, der bruges til at test
- Hvordan skriver du den kemiske reaktion af metan med klor?
- Hvor længe skal en ovn køres under typisk opvarmningscyklus?
- Hvad er carbon i isotope som reference til atommasseenhed?
- Hvor kan jeg købe sådan en stol? Denne app vil fortælle dig
- Forskere opdager, hvordan fisk udviklede sig til at flyde på forskellige havdybder
- Hvilken organelle ændrer eller pakningsproteiner til eksport fra cellen?


