Hvad er der nødvendigt for at afbalancere reaktionen CL2 KL KCL L2?
1. Identificer reaktanter og produkter
* reaktanter: Cl₂ (chlorgas), Ki (kaliumiodid)
* Produkter: KCL (kaliumchlorid), i₂ (jod)
2. Skriv den ubalancerede ligning
Cl₂ + ki → kcl + i₂
3. Balance atomerne
* klor (Cl): Der er 2 kloratomer til venstre (CL₂) og 1 til højre (KCL). For at balancere skal du lægge en koefficient på 2 foran KCL.
* kalium (k): Der er 1 kaliumatom til venstre (KI) og 2 til højre (2KCl). For at balancere skal du lægge en koefficient på 2 foran Ki.
* jod (i): Der er 1 iodatom til venstre (Ki) og 2 til højre (i₂). Ligningen er allerede afbalanceret for jod.
4. Den afbalancerede ligning
Den afbalancerede kemiske ligning er:
cl₂ + 2ki → 2kcl + i₂
Forklaring:
* Koefficienter: Tallene foran hvert molekyle repræsenterer antallet af molekyler involveret i reaktionen.
* bevarelse af masse: Den afbalancerede ligning sikrer, at det samme antal af hver type atom vises på begge sider af ligningen og opfylder loven om bevarelse af masse.
 Varme artikler
Varme artikler
-
 Forskere udforsker energibesparende katalysatorer, der fungerer ved stuetemperaturIllustrationen viser placeringen af en kemisk reaktion på guld-nanopartikler medieret af lokaliserede overfladeplasmoner - svingninger af gruppe af elektroner på overfladen af nanopartikler. Plasm
Forskere udforsker energibesparende katalysatorer, der fungerer ved stuetemperaturIllustrationen viser placeringen af en kemisk reaktion på guld-nanopartikler medieret af lokaliserede overfladeplasmoner - svingninger af gruppe af elektroner på overfladen af nanopartikler. Plasm -
 Hvidvin, citronsaft combo forhindrer uønsket misfarvning af wienerbrødsdejKredit:CC0 Public Domain Lige meget om det er bedstemors småkager eller kommercielt fremstillede rundstykker, wienerbrød elskere forventer, at deres bagværk har en vis gyldenbrun tiltrækning - men
Hvidvin, citronsaft combo forhindrer uønsket misfarvning af wienerbrødsdejKredit:CC0 Public Domain Lige meget om det er bedstemors småkager eller kommercielt fremstillede rundstykker, wienerbrød elskere forventer, at deres bagværk har en vis gyldenbrun tiltrækning - men -
 En plastikfilm, der kan dræbe vira ved hjælp af rumlysGrafisk abstrakt. Kredit:Journal of Photochemistry and Photobiology B:Biology (2022). DOI:10.1016/j.jphotobiol.2022.112551 Forskere ved Queens University Belfast har udviklet en plastikfilm, der ka
En plastikfilm, der kan dræbe vira ved hjælp af rumlysGrafisk abstrakt. Kredit:Journal of Photochemistry and Photobiology B:Biology (2022). DOI:10.1016/j.jphotobiol.2022.112551 Forskere ved Queens University Belfast har udviklet en plastikfilm, der ka -
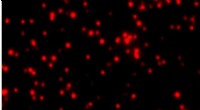 En meget følsom ny blodprøve kan påvise sjældne kræftproteinerDette SMAC -billede viser mutante p53 -proteiner i blodet hos en kræftpatient i æggestokkene. Individuelle klynger af p53 -molekyler er repræsenteret af røde pletter. Kredit:Shih-Chin Wang Protein
En meget følsom ny blodprøve kan påvise sjældne kræftproteinerDette SMAC -billede viser mutante p53 -proteiner i blodet hos en kræftpatient i æggestokkene. Individuelle klynger af p53 -molekyler er repræsenteret af røde pletter. Kredit:Shih-Chin Wang Protein


