Hvad er antallet af ioner modsat ladning omkring hver ion i en krystal?
Her er en sammenbrud:
* Koordinationsnummer: Dette antal repræsenterer antallet af nærmeste naboer med modsat ladning, der omgiver en bestemt ion i en krystalgitter.
* Krystalgitter: Dette er et tredimensionelt gentagende mønster af atomer eller ioner, der danner strukturen af et krystallinsk fast stof.
* Modsat afgift: Ionerne i et krystalgitter holdes sammen af elektrostatiske kræfter mellem ioner med modsatte ladninger (positivt og negativt).
Faktorer, der påvirker koordinationsnummer:
* ionisk radier: De relative størrelser af de involverede ioner. Mindre ioner kan passe nærmere omkring en større ion, hvilket fører til et højere koordineringsnummer.
* opladningstætheder: Forholdet mellem ladning og volumen af ionerne. Højere ladningstætheder kan føre til stærkere elektrostatiske interaktioner og dermed højere koordinationsnumre.
Eksempler:
* natriumchlorid (NaCl): I NaCl-krystalstrukturen er hver natriumion (Na+) omgivet af seks chloridioner (Cl-), og hver chloridion er omgivet af seks natriumioner. Koordinationsnummeret for både Na+ og Cl- er 6.
* cesiumchlorid (CSCL): I CSCL-strukturen er hver cesiumion (CS+) omgivet af otte chloridioner (Cl-), og hver chloridion er omgivet af otte kesiumioner. Koordinationsnummeret for både CS+ og CL- er 8.
Vigtig note: Koordinationsnummeret er en specifik værdi for hver krystalstruktur og kan variere afhængigt af den involverede ioner og selve krystalstrukturen.
Sidste artikelHvor mange faste stoffer er der i den periodiske tabel?
Næste artikelHvad er Titanium Noble Gas Configuration?
 Varme artikler
Varme artikler
-
 Ydre struktur kan påvirke enzymernes funktionMarkus Piotrowski foran en collage; et billede af nitrilasespiraler taget med et elektronmikroskop er vist forneden, en rekonstruktion af spiralen (beregnet ud fra elektron-mikroskopbilledet) til højr
Ydre struktur kan påvirke enzymernes funktionMarkus Piotrowski foran en collage; et billede af nitrilasespiraler taget med et elektronmikroskop er vist forneden, en rekonstruktion af spiralen (beregnet ud fra elektron-mikroskopbilledet) til højr -
 Skin et lys:Ny forskning viser, hvordan lavenergilys kan bøje plastikForskere afslørede en måde at bruge lavenergilys til at manipulere fotopolymerer eller plastfilm. Kredit:Florida State University Et hold af Florida State University-forskere har afsløret en måde a
Skin et lys:Ny forskning viser, hvordan lavenergilys kan bøje plastikForskere afslørede en måde at bruge lavenergilys til at manipulere fotopolymerer eller plastfilm. Kredit:Florida State University Et hold af Florida State University-forskere har afsløret en måde a -
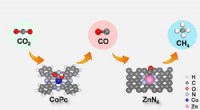 Tandemkatalysator til forbedring af kuldioxidelektroreduktion til metanCO2 reduceres først elektrokemisk til CO og derefter diffunderer CO til Zn-N-C for yderligere omdannelse til CH 4 over CoPc@Zn-N-C tandemkatalysator. Kredit:LIN Long og LIU Tianfu Kuldioxidreduk
Tandemkatalysator til forbedring af kuldioxidelektroreduktion til metanCO2 reduceres først elektrokemisk til CO og derefter diffunderer CO til Zn-N-C for yderligere omdannelse til CH 4 over CoPc@Zn-N-C tandemkatalysator. Kredit:LIN Long og LIU Tianfu Kuldioxidreduk -
 Web-baseret open source-program bestemmer proteinstrukturerStefan Arold (th.) og hans team spiller en afgørende rolle i det lokale videnskabelige samfund gennem samarbejde med andre forskningsgrupper i Kongeriget. Kredit:KAUST ContaMiner er en webbaseret,
Web-baseret open source-program bestemmer proteinstrukturerStefan Arold (th.) og hans team spiller en afgørende rolle i det lokale videnskabelige samfund gennem samarbejde med andre forskningsgrupper i Kongeriget. Kredit:KAUST ContaMiner er en webbaseret,
- Hvad er oxidationshalvreaktionen for 2 mg plus O2 lig med 2mgo?
- Hvorfor salatens mitokondrielle genom er som en hakket salat
- Fremskynder kvanteberegning ved hjælp af kæmpe atomioner
- En stjerne er en lys glødende sfære af varm?
- Hvorfor ser solen ud til at være lyseste stjerne i himlen for os på jorden?
- Dyrefølelser stirrer os i ansigtet - er vores kæledyr glade?


