Hvad er to elementer, der har egenskaber, der ligner klor?
* brom (Br): Brom er placeret direkte under klor i den periodiske tabel i den samme gruppe (halogener). Ligesom klor er det en ikke -metal, har en høj elektronegativitet og danner salte med metaller.
* fluor (F): Fluor er placeret direkte over klor i den periodiske tabel, også i halogengruppen. Det deler mange ligheder med klor, inklusive dets høje reaktivitet og evne til at danne stærke syrer.
Både brom og fluor har lignende kemiske egenskaber som klor på grund af deres delte elektronkonfiguration og tilstedeværelsen af syv valenselektroner, hvilket gør dem meget reaktive og tilbøjelige til at danne negative ioner.
Sidste artikelAluminiumscarbonat, når opvarmet nedbrydes?
Næste artikelLigner kemiske egenskaber ved ilt mere svovl eller fluor?
 Varme artikler
Varme artikler
-
 Video:Blev din katalysator stjålet? Her er hvorforKredit:The American Chemical Society Katalysatorer reducerer giftige bilemissioner, og, ifølge U.S. Environmental Protection Agency, de er en af de største miljøopfindelser nogensinde. I dag, t
Video:Blev din katalysator stjålet? Her er hvorforKredit:The American Chemical Society Katalysatorer reducerer giftige bilemissioner, og, ifølge U.S. Environmental Protection Agency, de er en af de største miljøopfindelser nogensinde. I dag, t -
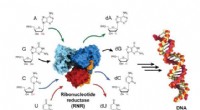 Biokemikere fanger og visualiserer et enzym, når det bliver aktivtRibonukleotidreduktase (RNR) -enzymet er ansvarligt for omdannelse af RNA -byggesten til DNA -byggesten, og er en kritisk spiller i både DNA -syntese og reparation i alle organismer. Kredit:Gyunghoon
Biokemikere fanger og visualiserer et enzym, når det bliver aktivtRibonukleotidreduktase (RNR) -enzymet er ansvarligt for omdannelse af RNA -byggesten til DNA -byggesten, og er en kritisk spiller i både DNA -syntese og reparation i alle organismer. Kredit:Gyunghoon -
 Højindeks overflade-eksponerede nanodendritter som ORR elektrokatalysatorVed hjælp af en atmosfære -skiftende strategi efterfulgt af elektrokemisk dealloying, forskere har syntetiseret sammensætningsgraderet PtCu 3 @Pt 3 Cu@Pt nanodendritter, der blotlægger overflader
Højindeks overflade-eksponerede nanodendritter som ORR elektrokatalysatorVed hjælp af en atmosfære -skiftende strategi efterfulgt af elektrokemisk dealloying, forskere har syntetiseret sammensætningsgraderet PtCu 3 @Pt 3 Cu@Pt nanodendritter, der blotlægger overflader -
 Brug af virtual reality-systemer til at undervise i kemi i 3-DEn abstrakt repræsentation af de fodboldformede buckminsterfulleren-molekyler i virtual reality. Kredit:Mike OConnor, i samarbejde med Interactive Scientific Ltd, under CC BY-ND 4.0. Et team af fo
Brug af virtual reality-systemer til at undervise i kemi i 3-DEn abstrakt repræsentation af de fodboldformede buckminsterfulleren-molekyler i virtual reality. Kredit:Mike OConnor, i samarbejde med Interactive Scientific Ltd, under CC BY-ND 4.0. Et team af fo
- En alkoholisk jodopløsning fremstilles ved at opløse 4,65 g krystaller i nok alkohol til at gøre …
- Hvordan adskiller koncentrationen af syre sig fra styrke en syre?
- NASA ser, at cyklonen Mora stadig slår slag efter land
- Hvad er lavet af forskellige atomer, der er sammenføjet?
- Navn til de sidste fem planeter fra Sun?
- Hvilken af de alkaliske jordmetaller er størst?


