Ligner kemiske egenskaber ved ilt mere svovl eller fluor?
* gruppeforhold: Oxygen og svovl er begge i gruppe 16 (via) af den periodiske tabel, kendt som chalcogenerne. Elementer inden for den samme gruppe deler lignende kemiske egenskaber på grund af at have det samme antal valenselektroner. Fluor er på den anden side i gruppe 17 (VIIA), halogenerne.
* Elektronegativitet: Mens både ilt og fluor er meget elektronegativ, er Sulphurs elektronegativitet tættere på ilt. Dette betyder, at både ilt og svovl har en tendens til at vinde elektroner i kemiske reaktioner og danne negative ioner (anioner). Fluor, der er det mest elektronegative element, har en meget højere elektronegativitet.
* Oxidation siger: Både ilt og svovl kan udvise en række oxidationstilstande, herunder -2, +2, +4 og +6. Fluor findes på den anden side næsten altid i en -1 oxidationstilstand.
* Forbindelsesdannelse: Oxygen og svovl danner lignende typer forbindelser, såsom oxider og sulfider. For eksempel kan både ilt og svovl danne forbindelser med metaller, såsom natriumoxid (Na₂O) og natriumsulfid (Na₂s).
Kortfattet: Mens både ilt og fluor er ikke -metaller, indikerer deres position i den periodiske tabel og deres elektronegativitetsværdier, at ilt deler mere lignende kemiske egenskaber med svovl end fluor.
Sidste artikelHvad er to elementer, der har egenskaber, der ligner klor?
Næste artikelHar brint en lav densitet?
 Varme artikler
Varme artikler
-
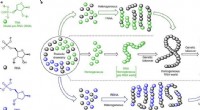 Forskere foreslår, at RNA og DNA startede med RNA-DNA-kimæreren, Konstitutionel formelrepræsentation af de tre oligonukleotid -byggesten, der blev undersøgt i denne undersøgelse. b, Tre mulige scenarier for fremkomsten af RNA og DNA fra præbiotisk kemi. Midt:
Forskere foreslår, at RNA og DNA startede med RNA-DNA-kimæreren, Konstitutionel formelrepræsentation af de tre oligonukleotid -byggesten, der blev undersøgt i denne undersøgelse. b, Tre mulige scenarier for fremkomsten af RNA og DNA fra præbiotisk kemi. Midt: -
 Forskere bruger maskinlæringsteknik til hurtigt at evaluere nye overgangsmetalforbindelserResultater fra en analyse af kunstigt neuralt netværk (ANN) er muligvis ikke pålidelige for molekyler, der er for forskellige fra dem, som ANN blev trænet på. De sorte skyer, der er vist her, dækker o
Forskere bruger maskinlæringsteknik til hurtigt at evaluere nye overgangsmetalforbindelserResultater fra en analyse af kunstigt neuralt netværk (ANN) er muligvis ikke pålidelige for molekyler, der er for forskellige fra dem, som ANN blev trænet på. De sorte skyer, der er vist her, dækker o -
 Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit
Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit -
 Opfindelse udløst af COVID-19-pandemi desinficerer overflader sikkert kontinuerligtKredit:Pixabay/CC0 Public Domain En opfindelse til at påføre plasma på genstande, der ofte berøres, til kontinuerlig desinfektion kunne give en sikker og effektiv, ikke-kemisk måde at reducere pat
Opfindelse udløst af COVID-19-pandemi desinficerer overflader sikkert kontinuerligtKredit:Pixabay/CC0 Public Domain En opfindelse til at påføre plasma på genstande, der ofte berøres, til kontinuerlig desinfektion kunne give en sikker og effektiv, ikke-kemisk måde at reducere pat


