Har brint en lav densitet?
* atomstruktur: Hydrogen har kun en proton og en elektron. Dette gør det til det mindste og letteste atom.
* molekylær struktur: Hydrogen findes som et diatomisk molekyle (H₂). Mens bindingen mellem de to hydrogenatomer er stærkt, er selve molekylet stadig meget lille og let.
* gas ved stuetemperatur: Hydrogen er en gas ved stuetemperatur og tryk. Gasser har meget lavere densiteter end faste stoffer eller væsker, fordi molekylerne er meget længere fra hinanden.
Sammenligning:
* Tætheden af brintgas ved standardbetingelser er ca. 0,0899 gram pr. Liter.
* Til sammenligning er lufttætheden ca. 1,225 gram pr. Liter.
* Vand har en densitet på 1 gram pr. Ml (eller 1000 gram pr. Liter).
Derfor er brint markant mindre tæt end luft eller vand. Denne lave tæthed er grunden til, at brint ofte bruges i applikationer som:
* balloner og luftskibe: Hydrogen's lave tæthed gør det flydende, hvilket giver det mulighed for at løfte genstande i luften.
* raketbrændstof: Hydrogen bruges som brændstof i raketter, fordi det har et højt energiindhold pr. Enhedsmasse.
Sidste artikelLigner kemiske egenskaber ved ilt mere svovl eller fluor?
Næste artikelEr polystyren en elementforbindelse eller blanding?
 Varme artikler
Varme artikler
-
 Varme klogere, ikke sværere:Hvordan mikrobølger gør katalytiske reaktioner mere effektiveKonventionel opvarmning kontra mikrobølgeopvarmning. Kredit:Tokyo Institute of Technology Mange reaktioner, som vi bruger til at producere kemiske forbindelser i fødevarer, medicinsk, og industrie
Varme klogere, ikke sværere:Hvordan mikrobølger gør katalytiske reaktioner mere effektiveKonventionel opvarmning kontra mikrobølgeopvarmning. Kredit:Tokyo Institute of Technology Mange reaktioner, som vi bruger til at producere kemiske forbindelser i fødevarer, medicinsk, og industrie -
 Nyt værktøj kunne behandle blodinfektioner hurtigtKredit:CC0 Public Domain Blodbaneinfektioner er notorisk dødelige. Ikke fordi de ikke kan behandles, men fordi de arbejder hurtigt og er svære at diagnosticere. For at finde ud af, hvilken medicin
Nyt værktøj kunne behandle blodinfektioner hurtigtKredit:CC0 Public Domain Blodbaneinfektioner er notorisk dødelige. Ikke fordi de ikke kan behandles, men fordi de arbejder hurtigt og er svære at diagnosticere. For at finde ud af, hvilken medicin -
 Sådan programmeres materialerAli Gooneie ser på en prøve fra sit seneste forskningsprojekt:elektrisk ledende polymerer. De første beregninger til hans næste projekt er skitseret på tavlen. Kredit:Empa Ali Gooneie simulerer på
Sådan programmeres materialerAli Gooneie ser på en prøve fra sit seneste forskningsprojekt:elektrisk ledende polymerer. De første beregninger til hans næste projekt er skitseret på tavlen. Kredit:Empa Ali Gooneie simulerer på -
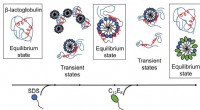 Fanget i sæbehånd:At forstå, hvordan sæbemolekyler hjælper proteiner med at komme ind og ud af …Resultater offentliggjort af AU-forskere afslører, at surfaktant-medieret udfoldning og genfoldning af proteiner er komplekse processer med flere strukturer til stede, og omarrangeringer sker på tidss
Fanget i sæbehånd:At forstå, hvordan sæbemolekyler hjælper proteiner med at komme ind og ud af …Resultater offentliggjort af AU-forskere afslører, at surfaktant-medieret udfoldning og genfoldning af proteiner er komplekse processer med flere strukturer til stede, og omarrangeringer sker på tidss
- Biden roser NASA-teamet for at give USA en dosis af tillid
- Magnetisk perlemanipulation i mikrofluidchips til biologisk anvendelse
- Udsigter for en helt optisk fjernmagnetisk feltsensor
- Hvordan kul adfærd elektricitet?
- Hvordan opfører syrer sig i vandopløsning?
- Centraleuropæisk forhistorie var meget dynamisk


