Fanget i sæbehånd:At forstå, hvordan sæbemolekyler hjælper proteiner med at komme ind og ud af form
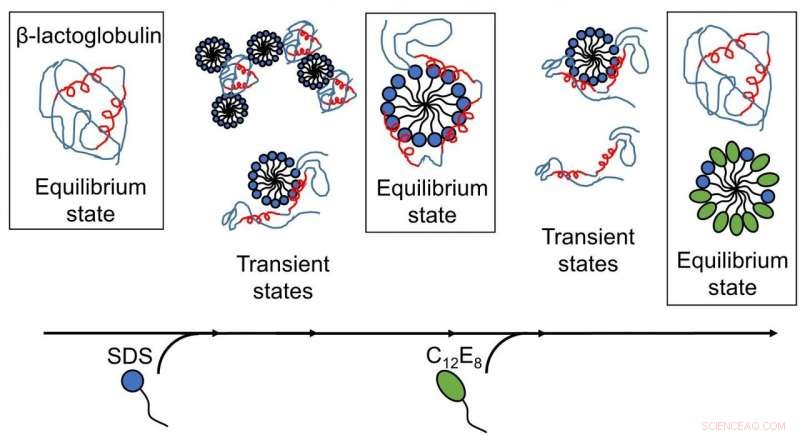
Resultater offentliggjort af AU-forskere afslører, at surfaktant-medieret udfoldning og genfoldning af proteiner er komplekse processer med flere strukturer til stede, og omarrangeringer sker på tidsskalaer fra sub-millisekunder til minutter. (Billede:Gengivet med tilladelse fra Royal Society of Chemistry). Kredit: Chem Sci , copyright 2020 Royal Society of Chemistry.
At forstå samspillet mellem proteiner og sæbemolekyler (overfladeaktive stoffer) har længe været vigtigt for industrien, især inden for vaskemidler og kosmetik. Det anioniske overfladeaktive stof natriumdodecylsulfat (SDS) er kendt for at udfolde kugleformede proteiner, mens det ikke-ioniske overfladeaktive stof octaethylenglycol monododecylether (C12E8) gør det modsatte, dvs. det hjælper proteiner med at folde sig i form igen.
For at vaskepulver skal fungere effektivt, det er vigtigt, at de overfladeaktive stoffer ikke ændrer strukturen af proteiner (enzymer), da enhver ændring i enzymstruktur dræber deres evne til at nedbryde pletter og fjerne snavs. De fleste vaskepulvere indeholder blandinger af overfladeaktive stoffer, som gør det muligt for enzymerne at forblive aktive. Også, nogle bioteknologier udnytter overfladeaktive stoffer i kombination med proteiner.
Membranproteiner sidder normalt i cellemembranen. For at udtrække dem fra dette miljø til forskellige undersøgelser, de skal opløses af overfladeaktivt middel. Det overfladeaktive middel skal være 'skånsomt' og kun dække den membranindsatte del af proteinet, så deres struktur bevares. I modsætning, når man karakteriserer molekylvægten af proteiner i laboratoriet, en standardteknik er at folde dem ud af det aggressive negativt ladede overfladeaktive stof, SDS, og overvåge, hvordan de migrerer i en polymergel i et elektrisk felt. Denne teknik virker kun, hvis det overfladeaktive middel udfolder proteinerne fuldstændigt og ødelægger deres struktur.
Der er stadig debat om, hvilken type interaktioner mellem proteinet og det overfladeaktive stof, der er vigtigst. Er det de elektrostatiske vekselvirkninger mellem ladningerne af det overfladeaktive stof og proteinet, eller er det blot egenskaberne ved grænsefladen af aggregaterne (miceller), som de overfladeaktive stoffer danner i vand, hvilke er ansvarlige for udfoldelsen af proteinet?
Mens udfoldelse er blevet undersøgt i detaljer på proteinniveau, et fuldstændigt billede af interaktionen mellem protein og overfladeaktivt stof mangler i disse processer. Denne mangel på viden behandles i det nuværende arbejde med at bruge det globulære protein β-lactoglobulin (bLG) som et modelprotein.
Den rigtige kombination af eksperimentelle teknikker
Dybere indsigt i udfoldning og genfoldning af proteiner blev opnået, da de forskellige trin af interaktioner mellem overfladeaktivt middel og proteiner blev kortlagt som en funktion af tiden. For det første, modelproteinet, bLG, blev blandet med det anioniske overfladeaktive middel SDS, mens man fulgte tidsudviklingen af dannelsen af komplekser mellem protein- og overfladeaktive molekyler på millisekund-minut tidsskalaen. Herved har forskerne bestemt strukturen af de udviklende komplekser. Efterfølgende kortlagde de tidsforløbet af genfoldningsprocessen, når ikke-ladet overfladeaktivt middel (C12E8) blev tilsat til en prøve indeholdende komplekser af SDS og protein.
For at observere, hvordan proteinet omarrangeres under udfoldnings- og genfoldningsprocessen induceret af overfladeaktive stoffer, komplementære spektroskopiske teknikker, cirkulær dikroisme og tryptofanfluorescens, blev brugt i kombination med tidsopløst Small-angle X-ray scattering (SAXS).
Cirkulær dikroisme og tryptofanfluorescens overvåger ændringer i strukturen af bLG, mens ændringer i den overordnede form af protein-overfladeaktive komplekserne blev fulgt af synkrotron SAXS. Denne kombination af teknikker er ikke blevet brugt før til at studere disse processer.
Komplekse processer, der varer fra millisekunder til minutter
Udfoldelsen af proteinet ved SDS var en homogen proces, hvor alle proteinmolekyler følger den samme udfoldelsesrute. SDS-komplekserne (micellerne) angriber proteinmolekylerne frontalt og folder derefter proteinet gradvist ud, så det danner en skal omkring SDS-micellen. Genfoldning starter, når C12E8-miceller "suger" SDS ud fra protein-SDS-komplekset for at danne blandede SDS-C12E8-miceller. Imidlertid, selve genfoldningsprocessen ser ud til at følge flere ruter, da flere strukturer blev fundet at danne parallelt, nemlig protein-overfladeaktive komplekser (sandsynligvis indeholdende både SDS og C12E8), blandede miceller af SDS og C12E8, "nøgne" proteiner udfoldede sig som lange polymere kæder, og korrekt foldede proteiner. Forsøget gjorde det muligt at følge indbyrdes omdannelse mellem disse arter, so that it could be determined which of the processes are fast and which ones are slow. The folded protein could form both from the naked unfolded proteins (quickly) and from protein-surfactant complexes (more slowly). Dermed, the best way in which surfactants can help a protein to fold is to basically get out of the way and let the protein find its own way back to the folded state.
The results have provided deeper insight into the structural changes occurring at the protein-surfactant level. They revealed that surfactant-mediated unfolding and refolding of proteins are complex processes of rearrangements occurring on time scales from below milliseconds to minutes and involve intimate collaboration between surfactant complexes and proteins.
Sidste artikelUsynlige røntgenstråler bliver blå
Næste artikelOligomerer observerede at efterligne kombinationen af DNA-strenge
 Varme artikler
Varme artikler
-
 Kemikere bruger massespektrometriværktøjer til at bestemme alder på fingeraftrykKemikerne Young-Jin Lee og Paige Hinners har muligvis fundet en måde at afgøre, hvornår et fingeraftryk blev efterladt. Kredit:Christopher Gannon/Iowa State University Fingeraftryk fortæller os me
Kemikere bruger massespektrometriværktøjer til at bestemme alder på fingeraftrykKemikerne Young-Jin Lee og Paige Hinners har muligvis fundet en måde at afgøre, hvornår et fingeraftryk blev efterladt. Kredit:Christopher Gannon/Iowa State University Fingeraftryk fortæller os me -
 Appellerende fund tyder på, hvorfor køling dæmper bananaromaerKredit:American Chemical Society Bananer er en af verdens mest populære frugter. Men hvordan de opbevares, før de når dagligvarehylderne, kan påvirke deres smag og lugt negativt. Nu i en undersø
Appellerende fund tyder på, hvorfor køling dæmper bananaromaerKredit:American Chemical Society Bananer er en af verdens mest populære frugter. Men hvordan de opbevares, før de når dagligvarehylderne, kan påvirke deres smag og lugt negativt. Nu i en undersø -
 Cheminformatics tilgange til at skabe nye hårfarverForskere bruger Max Weaver Dye Library til at finde nye, sikrere hårfarveprodukter. Kredit:George Van Den Driessche. At finde den næste generation af sikrere hårfarver kan være lige så simpelt som
Cheminformatics tilgange til at skabe nye hårfarverForskere bruger Max Weaver Dye Library til at finde nye, sikrere hårfarveprodukter. Kredit:George Van Den Driessche. At finde den næste generation af sikrere hårfarver kan være lige så simpelt som -
 Forudsigelse af udfaldet af våbenkapløbet mellem mennesker og bakterierEt bakterieenzym, der frigiver fragmenter af clavulansyre, en resistensblokker designet til at overvinde antibiotikaresistente infektioner. Destruktion af clavulansyre gør det muligt for enzymet at be
Forudsigelse af udfaldet af våbenkapløbet mellem mennesker og bakterierEt bakterieenzym, der frigiver fragmenter af clavulansyre, en resistensblokker designet til at overvinde antibiotikaresistente infektioner. Destruktion af clavulansyre gør det muligt for enzymet at be
- Strøm af stjerner strækker sig tusinder af lysår hen over Mælkevejen
- Adoptivforældre søger længere orlov
- Bekymret for seksuel chikane – eller falske påstande? Vores team spurgte amerikanere om deres erfar…
- De koldeste temperaturer registreret i løbet af 120 års vejrdata
- Børnevidenskabsprojekter om ting, der Melt
- Hjælp med forudgående beskæftigelse Math Test Questions


