Hvorfor er natriumchlorid ikke reaktivt, men og klor er meget reaktive?
natriumchlorid (NaCl)
* ionisk forbindelse: Natriumchlorid er en ionisk forbindelse, hvilket betyder, at det dannes af den elektrostatiske tiltrækning mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-). Denne stærke attraktion skaber en meget stabil struktur.
* octet regel: Både natrium og klor opnår en stabil elektronkonfiguration ved at vinde eller miste elektroner. Natrium mister en elektron for at blive Na+, og klor får en elektron til at blive Cl-. Denne stabile konfiguration gør dem mindre tilbøjelige til at reagere yderligere.
* Høj gitterenergi: Den stærke tiltrækning mellem ionerne i natriumchlorid resulterer i en høj gitterenergi, hvilket betyder, at der kræves en masse energi for at bryde bindingerne mellem ionerne.
klor (cl 2 )
* diatomisk molekyle: Klor findes som et diatomisk molekyle (CL 2 ), hvilket betyder, at to kloratomer er bundet sammen. Denne binding er relativt svag sammenlignet med de ioniske bindinger i natriumchlorid.
* Elektronaffinitet: Klor har en høj elektronaffinitet, hvilket betyder, at det let får elektroner for at opnå en stabil elektronkonfiguration.
* Oxideringsmiddel: Chlor er et stærkt oxidationsmiddel, hvilket betyder, at det let accepterer elektroner fra andre stoffer, hvilket gør det meget reaktivt.
Kortfattet:
* natriumchlorid er stabilt på grund af dets stærke ioniske bindinger, stabile elektronkonfigurationer og høj gitterenergi. Det er i det væsentlige en "tilfreds" forbindelse.
* klor er reaktiv på grund af dets svage diatomiske binding, høj elektronaffinitet og evne til at fungere som et oxidationsmiddel. Den søger at få elektroner og danne stabile bindinger med andre elementer.
Fortæl mig, hvis du har andre kemi -spørgsmål!
Sidste artikelHvor mange atomer er der i nitrogen?
Næste artikelKan kobberchlorid opdeles i noget enklere?
 Varme artikler
Varme artikler
-
 Forskere frigiver det første kemiske kort over farvestoffer fra det historiske farvebibliotekPrøver fra Max A. Weavers farvestofbibliotek. Kredit:NC State University Forskere fra North Carolina State University har frigivet det første kemiske kort over farvestoffer fra Max A. Weaver Dye L
Forskere frigiver det første kemiske kort over farvestoffer fra det historiske farvebibliotekPrøver fra Max A. Weavers farvestofbibliotek. Kredit:NC State University Forskere fra North Carolina State University har frigivet det første kemiske kort over farvestoffer fra Max A. Weaver Dye L -
 En mere effektiv membranbaseret generator til høst af osmotisk kraft (opdatering)Skematisk afbildning af Janus 3D porøs membranbaseret osmotisk kraftgenerator. (A) Forberedelsesproces af Janus nanoporøse membran. (B og D) Kemisk struktur (øverst), mikrostruktur af ionomerer (midte
En mere effektiv membranbaseret generator til høst af osmotisk kraft (opdatering)Skematisk afbildning af Janus 3D porøs membranbaseret osmotisk kraftgenerator. (A) Forberedelsesproces af Janus nanoporøse membran. (B og D) Kemisk struktur (øverst), mikrostruktur af ionomerer (midte -
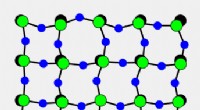 Hemmeligheden bag krystaller, der krymper ved opvarmningDenne animation viser, hvordan faste krystaller af scandiumfluorid krymper ved opvarmning. Mens bindingerne mellem scandium (grøn) og fluoratomer (blå) forbliver relativt stive, fluoratomerne langs si
Hemmeligheden bag krystaller, der krymper ved opvarmningDenne animation viser, hvordan faste krystaller af scandiumfluorid krymper ved opvarmning. Mens bindingerne mellem scandium (grøn) og fluoratomer (blå) forbliver relativt stive, fluoratomerne langs si -
 Ingeniører forvandler plastisolator til varmelederForskere på MIT har designet en ny måde at konstruere en polymerstruktur på molekylært niveau, via kemisk dampaflejring. Dette giver mulighed for stive, bestilte kæder, kontra det rodede, spaghetti-li
Ingeniører forvandler plastisolator til varmelederForskere på MIT har designet en ny måde at konstruere en polymerstruktur på molekylært niveau, via kemisk dampaflejring. Dette giver mulighed for stive, bestilte kæder, kontra det rodede, spaghetti-li
- Hvad sker der, når kulsyre reagerer med kalsit?
- Hvordan er lypider og proteiner ens?
- Hvorfor har indre vægge af vakuumkolber sølvbelægning?
- Brug af maskinlæring til at rekonstruere forringede Van Gogh-tegninger
- Nye overfladeakustiske bølgeteknikker kan føre til at surfe på et kvanteinternet
- Hvordan kan et forvitret bjerg se anderledes ud end et uvejret bjerg?


