Er der en reaktion mellem calciumcarbonat og hydrogenperoxid?
* calciumcarbonat er en base: Det er et salt, der danner en grundlæggende opløsning, når den opløses i vand.
* Hydrogenperoxid er et svagt oxidationsmiddel: Det kan nedbrydes i vand og ilt og frigive en lille mængde energi.
* Ingen direkte kemisk reaktion: Reaktionen mellem et svagt oxidationsmiddel og en base er typisk ikke en stærk reaktion. Mens en meget langsom reaktion kan forekomme, er den ubetydelig og producerer ikke nogen mærkbare ændringer.
Der er dog et par ting at overveje:
* tilstedeværelse af en katalysator: I nærvær af en katalysator, som visse metalioner eller enzymer, kan hydrogenperoxid nedbrydes meget hurtigere i vand og ilt. Denne nedbrydning kan potentielt forårsage en lille reaktion med calciumcarbonat, men det ville stadig være meget langsomt.
* Effekt på miljøet: Hvis hydrogenperoxid er i en koncentreret opløsning, kan det forårsage en let opløsning af calciumcarbonat over tid. Dette skyldes primært den sure karakter af hydrogenperoxidopløsningen snarere end en direkte kemisk reaktion.
Konklusion: Selvom der muligvis er en minimal reaktion mellem calciumcarbonat og hydrogenperoxid under specifikke betingelser, er det ikke en signifikant eller bemærkelsesværdig reaktion under normale omstændigheder.
 Varme artikler
Varme artikler
-
 Enheden kan hjælpe med at opdage tegn på udenjordisk livEn fuldautomatisk mikrochip-elektroforeseanalysator kunne en dag blive indsat i søgen efter liv på andre verdener. Kredit:Tilpasset fra Analytisk kemi 2020, DOI:10.1021/acs.analchem.0c01628 Selv
Enheden kan hjælpe med at opdage tegn på udenjordisk livEn fuldautomatisk mikrochip-elektroforeseanalysator kunne en dag blive indsat i søgen efter liv på andre verdener. Kredit:Tilpasset fra Analytisk kemi 2020, DOI:10.1021/acs.analchem.0c01628 Selv -
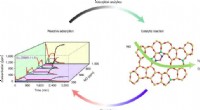 Ingeniører løser mysteriet om struktur-egenskabsforhold i emissionskontrolkatalysatorerGrafisk abstrakt. Kredit: Naturkatalyse (2021). DOI:10.1038/s41929-020-00555-0 Miljøbevarelse og fremtidig bæredygtighed kræver innovation fra kemiingeniører, fra justeringer til den mikroskopisk
Ingeniører løser mysteriet om struktur-egenskabsforhold i emissionskontrolkatalysatorerGrafisk abstrakt. Kredit: Naturkatalyse (2021). DOI:10.1038/s41929-020-00555-0 Miljøbevarelse og fremtidig bæredygtighed kræver innovation fra kemiingeniører, fra justeringer til den mikroskopisk -
 Stanford-forskning kan føre til injicerbare geler, der frigiver medicin over tidKredit:Pixabay/CC0 Public Domain Geler dannes ved at blande polymerer i væsker for at skabe klistrede stoffer, der er nyttige til alt fra at holde hår på plads til at gøre det muligt for kontaktli
Stanford-forskning kan føre til injicerbare geler, der frigiver medicin over tidKredit:Pixabay/CC0 Public Domain Geler dannes ved at blande polymerer i væsker for at skabe klistrede stoffer, der er nyttige til alt fra at holde hår på plads til at gøre det muligt for kontaktli -
 Oprydning af brintoverilteproduktionSolugens proprietære proces til fremstilling af hydrogenperoxid bruger modificerede enzymer og billige forbindelser som sukker. Det bliver i øjeblikket brugt i to pilotanlæg, der producerer mere end 1
Oprydning af brintoverilteproduktionSolugens proprietære proces til fremstilling af hydrogenperoxid bruger modificerede enzymer og billige forbindelser som sukker. Det bliver i øjeblikket brugt i to pilotanlæg, der producerer mere end 1
- Hvilken formel repræsenterer en molekylær forbindelse?
- Hvad er celledele til organeller?
- Vil et let eller tungt objekt gå længere i katapult?
- Hvem var botanikeren, der konkluderede, at alle planter er sammensat af celler?
- Hvordan sammenlignes energiforbrug i løbet af forskellige sæsoner af året?
- Sådan konverteres kortgitterkoordinater til Latitude & Longitude


