Hvilken formel repræsenterer en molekylær forbindelse?
Karakteristika for molekylære forbindelser:
* ikke -metaller: Molekylære forbindelser dannes typisk mellem to eller flere ikke -metaller.
* Subskripter: Underskrifterne i formlen angiver antallet af atomer for hvert element, der er til stede i molekylet.
Eksempel:
* h₂o (Vand) er en molekylær forbindelse, fordi det består af brint (H) og ilt (O), begge ikke -metaller. Underskrifterne "2" og "1" (implicit) indikerer to hydrogenatomer og et iltatom pr. Molekyle.
Nøglepunkter:
* ioniske forbindelser (dannet mellem metaller og ikke-metaller) er typisk repræsenteret af empiriske formler, der viser det enkleste forhold mellem hele antal i ioner i forbindelsen.
* molekylære formler Repræsentere det faktiske antal atomer i hvert element i et molekyle.
* strukturelle formler Giv en visuel repræsentation af arrangementet af atomer inden for et molekyle.
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelVand ioniserer i hydrogenioner og hydroxidioner. Det har en?
Næste artikelHvad er molariteten af ren flydende benzen?
 Varme artikler
Varme artikler
-
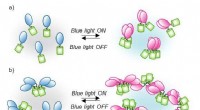 Proteinblanding under blåt lysSkema af CRY2PHR klyngemekanismen udløst af blåt lys. I dette optogenetiske system, CRY2-klynger (blå og pink) styres reversibelt af blåt lys. Hvis CRY2 er forbundet med fluorescerende proteiner (grøn
Proteinblanding under blåt lysSkema af CRY2PHR klyngemekanismen udløst af blåt lys. I dette optogenetiske system, CRY2-klynger (blå og pink) styres reversibelt af blåt lys. Hvis CRY2 er forbundet med fluorescerende proteiner (grøn -
 Teknologi, der forudsiger proteinstabilitet, er frigivet af det britiske universitets spin-out selsk…QUBES tager et fingeraftryk af proteinfluorescens og konverterer det til en forudsigelse af proteinstabilitet samt overvågning for ændringer i proteinstruktur. QUBES er en cloud-hostet softwareplatfor
Teknologi, der forudsiger proteinstabilitet, er frigivet af det britiske universitets spin-out selsk…QUBES tager et fingeraftryk af proteinfluorescens og konverterer det til en forudsigelse af proteinstabilitet samt overvågning for ændringer i proteinstruktur. QUBES er en cloud-hostet softwareplatfor -
 Saturns største måne kan være nøglen til renere motorerTitans atmosfæriske dis, Saturns største måne (billedet her langs Saturns midtersektion), er fanget i dette naturlige farvebillede (boks til venstre). Kredit:NASA Jet Propulsion Laboratory, Space Scie
Saturns største måne kan være nøglen til renere motorerTitans atmosfæriske dis, Saturns største måne (billedet her langs Saturns midtersektion), er fanget i dette naturlige farvebillede (boks til venstre). Kredit:NASA Jet Propulsion Laboratory, Space Scie -
 Skaber grønt protein fra luftenKredit:CC0 Public Domain Stigende miljømæssige udfordringer har fået forskere til at genoverveje, hvordan protein kan produceres. Traditionelle processer kræver meget plads til lands eller til van
Skaber grønt protein fra luftenKredit:CC0 Public Domain Stigende miljømæssige udfordringer har fået forskere til at genoverveje, hvordan protein kan produceres. Traditionelle processer kræver meget plads til lands eller til van
- Hvilken slags energi ville en skiløber have på den øverste bakke mere end bundbakken?
- Ren brint:En længe ventet løsning til sektorer, der er svære at reducere?
- Havets kylling? Tunavl får et løft
- Forskere udvikler ultrafølsomme flow-mikrosensorer
- Reaktionen pbbr2s pb2 aq 2br-aq har nået mætning med koncentrationerne 2,5 x 10-3 og br- 5,0 10-2 …
- Lavede Gud planeterne og Suns eller Bigbang?


