Hvorfor er størrelsen på en natriumion na mindre end atom NA?
* Elektronkonfiguration: Et natriumatom har 11 elektroner, hvor det yderste elektron er i 3'erne orbital. Når natrium mister dette yderste elektron for at blive en positivt ladet ion (Na+), mister det hele sit tredje energiniveau.
* Effektiv nuklearafgift: Den positive ladning af kernen tiltrækker elektronerne. Når et natriumatom mister et elektron, forbliver antallet af protoner i kernen det samme, men der er nu færre elektroner. Dette betyder, at de resterende elektroner trækkes stærkere ind af kernen, hvilket resulterer i en mindre ionisk radius.
* afskærmning: De indre elektroner beskytter de ydre elektroner mod kernenes fulde tiltrækning. Med tabet af det yderste elektron oplever de resterende elektroner mindre afskærmning, hvilket øger tiltrækningen af kernen og forårsager en yderligere reduktion i størrelse.
Kortfattet: Tabet af et elektron i natrium resulterer i en mindre ionisk radius på grund af den øgede effektive atomladning og reduceret elektronelektron-frastødelse.
 Varme artikler
Varme artikler
-
 En type halvgennemsigtig polymer, der kan repareres ved stuetemperatur ved hjælp af lille trykKredit:Yu Yanagisawa Et lille team af forskere ved University of Tokyo har skabt en polymer, der kan repareres, når den brydes i to dele ved at påføre et lille tryk ved stuetemperatur. I deres pap
En type halvgennemsigtig polymer, der kan repareres ved stuetemperatur ved hjælp af lille trykKredit:Yu Yanagisawa Et lille team af forskere ved University of Tokyo har skabt en polymer, der kan repareres, når den brydes i to dele ved at påføre et lille tryk ved stuetemperatur. I deres pap -
 Forskere arbejder på kuldioxidopsamlingssystemerMissouri S&T professor Fateme Rezaei, venstre, og studerende Harshul Thakkar arbejder sammen i Bertelsmeyer Hall om at udvikle teknologi, der hjælper med at holde astronauter sikre mod kuldioxidopbygn
Forskere arbejder på kuldioxidopsamlingssystemerMissouri S&T professor Fateme Rezaei, venstre, og studerende Harshul Thakkar arbejder sammen i Bertelsmeyer Hall om at udvikle teknologi, der hjælper med at holde astronauter sikre mod kuldioxidopbygn -
 Enzymer med succes indlejret i plastProduktion af en biofunktionaliseret film i forarbejdningspilotanlægget. Kredit:Fraunhofer IAP Generelt, plast bliver behandlet ved langt over hundrede grader celsius. Enzymer, derimod, kan normal
Enzymer med succes indlejret i plastProduktion af en biofunktionaliseret film i forarbejdningspilotanlægget. Kredit:Fraunhofer IAP Generelt, plast bliver behandlet ved langt over hundrede grader celsius. Enzymer, derimod, kan normal -
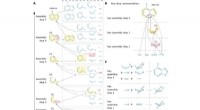 Samlingsteori kan betyde gode nyheder for lægemiddelopdagelseFig. 1. Repræsentationer af en samlingsvej, ved at tage adenin som eksempel. (A) En af adenins mange samlingsveje (det viser sig at være den korteste, ifølge vores MC-algoritme, forklaret senere). Sam
Samlingsteori kan betyde gode nyheder for lægemiddelopdagelseFig. 1. Repræsentationer af en samlingsvej, ved at tage adenin som eksempel. (A) En af adenins mange samlingsveje (det viser sig at være den korteste, ifølge vores MC-algoritme, forklaret senere). Sam
- Er en regnbue biotisk eller abiotisk?
- Hvordan bruger fly princip?
- Forskere har fremstillet to typer trelagsgrafen med forskellige elektriske egenskaber
- Når statisk elektricitet opbygger for meget det?
- Teknik kunne producere stærk, modstandsdygtige nanofibre til mange applikationer
- Hvilken strømkilde frigiver elektroner på den ene side og accepterer dem den anden a. Et elektrisk…


