Hvorfor har svovl lavt smeltepunkt?
* svage intermolekylære kræfter: Svovl findes som en pucket ringstruktur (S8) i sin faste form. De intermolekylære kræfter, der holder disse ringe sammen, er primært van der Waals -styrker. Disse kræfter er relativt svage sammenlignet med andre typer intermolekylære kræfter som hydrogenbinding eller dipol-dipol-interaktioner.
* stor atomstørrelse: Svovl er et relativt stort atom med en diffus elektronsky. Dette fører til svage spredningskræfter mellem svovlatomerne, hvilket yderligere bidrager til det lave smeltepunkt.
* begrænset kovalent binding: Mens svovlatomer er bundet sammen i S8 -ringen, er der begrænsede kovalente bindinger mellem forskellige ringe. Dette betyder, at der er færre stærke interaktioner, der skal overvindes under faseovergangen fra fast til væske.
I modsætning til svovl udviser elementer med højere smeltepunkter typisk stærkere intermolekylære kræfter, som ionisk binding (f.eks. Natriumchlorid) eller stærk metallisk binding (f.eks. Jern).
Det er vigtigt at bemærke, at selvom svovl har et relativt lavt smeltepunkt sammenlignet med mange andre elementer, er det stadig højere end mange andre ikke-metaler som brom og jod. Dette skyldes, at svovlens S8-ringstruktur giver en vis grad af stabilitet, hvilket bidrager til et højere smeltepunkt end ikke-metaler med svagere intermolekylære kræfter.
 Varme artikler
Varme artikler
-
 Et nyt materiale til fremtidens batteriUCLouvains forskere opdagede et nyt højtydende og sikkert batterimateriale (LTPS), der kan fremskynde opladning og afladning til et niveau, der aldrig er observeret hidtil. Kredit:University of Louvai
Et nyt materiale til fremtidens batteriUCLouvains forskere opdagede et nyt højtydende og sikkert batterimateriale (LTPS), der kan fremskynde opladning og afladning til et niveau, der aldrig er observeret hidtil. Kredit:University of Louvai -
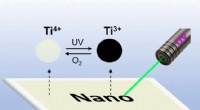 Skriv med lys på titaniumdioxid:Overskrivbare UV-følsomme overflader lavet af dopede TiO2 nanokrys…Grafisk abstrakt. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202203700 Det er lykkedes for forskere at fremstille et belægningsmateriale, der kan skrives på ved hjælp a
Skriv med lys på titaniumdioxid:Overskrivbare UV-følsomme overflader lavet af dopede TiO2 nanokrys…Grafisk abstrakt. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202203700 Det er lykkedes for forskere at fremstille et belægningsmateriale, der kan skrives på ved hjælp a -
 I felttest, enheden høster vand fra ørkenluftenKredit:CC0 Public Domain Det ser ud til at få noget for ingenting, men du kan virkelig få drikkevand lige ud af den tørreste af ørkenluft. Selv på de mest tørre steder på Jorden, der er lidt fugt
I felttest, enheden høster vand fra ørkenluftenKredit:CC0 Public Domain Det ser ud til at få noget for ingenting, men du kan virkelig få drikkevand lige ud af den tørreste af ørkenluft. Selv på de mest tørre steder på Jorden, der er lidt fugt -
 Grøn metan fra kunstig fotosyntese kunne genbruge CO2Et elektronmikroskopbillede viser halvlederens nanotråde. Disse leverer elektroner til metal nanopartikler, som gør kuldioxid og vand til metan. Kredit:Baowen Zhou En ny kunstig fotosyntesemetode
Grøn metan fra kunstig fotosyntese kunne genbruge CO2Et elektronmikroskopbillede viser halvlederens nanotråde. Disse leverer elektroner til metal nanopartikler, som gør kuldioxid og vand til metan. Kredit:Baowen Zhou En ny kunstig fotosyntesemetode
- Er tandsyresyre mættet eller umættet?
- Hvad er komplekse bjerge?
- Hvad er densiteten af ethylenvinylacetat?
- Hvad er energien fra en mol fotoner rødt lys med bølgelængde 632nm?
- Hvilken form for lagret energi har en bog, mens den stadig er på den høje hylde?
- Når afstrømning rejser ned ad bakke, danner det små lunde i jorden kaldet?


