Har svovl en lavere ioniseringsenergi end klor?
Her er hvorfor:
* Elektronkonfiguration: Svovl har elektronkonfigurationen [NE] 3S² 3P⁴, mens klor har [NE] 3S² 3P⁵. Dette betyder, at svovl har en lidt mindre stabil elektronkonfiguration sammenlignet med klor, der har et halvfyldt P-underskal.
* Effektiv nuklearafgift: Klor har en højere effektiv nuklear ladning (den nettopositive ladning, der opleves af et elektron) end svovl. Dette skyldes, at klor har flere protoner i sin kerne og trækker elektronerne stærkere.
* afskærmning: Mens begge elementer har det samme antal indre skalelektroner, har klor endnu en elektron i den yderste skal, hvilket øger afskærmningseffekten. Dette betyder, at den yderste elektron i svovl oplever en lidt mindre effektiv afskærmningseffekt fra de indre elektroner.
generelt: Den kombinerede virkning af disse faktorer gør det lettere at fjerne et elektron fra svovlens yderste skal, hvilket resulterer i en lavere ioniseringsenergi sammenlignet med klor.
 Varme artikler
Varme artikler
-
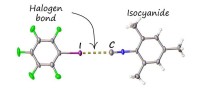 Ny ikke -kovalent binding blokerer frastødende lugt af isocyaniderStrukturen af associerede iodopentafluorobensen med mesityl isocyanid, etableret ved røntgendiffraktion ved Research Park ved St. Petersburg State University. Kredit:SPbU Isocyanider er en vigti
Ny ikke -kovalent binding blokerer frastødende lugt af isocyaniderStrukturen af associerede iodopentafluorobensen med mesityl isocyanid, etableret ved røntgendiffraktion ved Research Park ved St. Petersburg State University. Kredit:SPbU Isocyanider er en vigti -
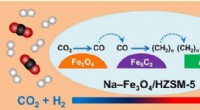 Forskere udvikler en effektiv multifunktionel katalysator til CO2-hydrogenering til benzinCO2-hydrogenering til carbonhydrider i benzinområdet over Na-Fe3O4/Zeolite multifunktionel katalysator. Kredit:WEI Jian Konvertering af CO2 fra en skadelig drivhusgas til værdiskabende flydende br
Forskere udvikler en effektiv multifunktionel katalysator til CO2-hydrogenering til benzinCO2-hydrogenering til carbonhydrider i benzinområdet over Na-Fe3O4/Zeolite multifunktionel katalysator. Kredit:WEI Jian Konvertering af CO2 fra en skadelig drivhusgas til værdiskabende flydende br -
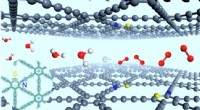 Forskere udvikler stereodefineret N- og S-atom-kodoperet grafdiyn til iltudviklingStereodefinerede sp-N- og S-atomer til effektiv iltudvikling. Kredit:Zhao Yasong Iltudviklingsreaktionen (OER) er af stor betydning i energirelaterede teknikker såsom metal-luft-batterier og vands
Forskere udvikler stereodefineret N- og S-atom-kodoperet grafdiyn til iltudviklingStereodefinerede sp-N- og S-atomer til effektiv iltudvikling. Kredit:Zhao Yasong Iltudviklingsreaktionen (OER) er af stor betydning i energirelaterede teknikker såsom metal-luft-batterier og vands -
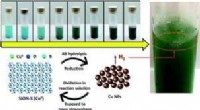 Forskere finder selvhelbredende katalysator til potentiel storstilet brug i brintproduktionForskerne overvejede regenerering, eller selvhelbredende -- katalysatorens evne til spontant at reparere sig selv under normale operationer -- er det mest attraktive træk. Kredit:EPFL Forskere, de
Forskere finder selvhelbredende katalysator til potentiel storstilet brug i brintproduktionForskerne overvejede regenerering, eller selvhelbredende -- katalysatorens evne til spontant at reparere sig selv under normale operationer -- er det mest attraktive træk. Kredit:EPFL Forskere, de
- Hvad er de fire principper klasser af organiske forbindelser?
- Mercury Venus Earth og Mars blev dannet af hvad?
- Overlevelsesstrategi:Hvordan et enzym hjælper bakterier med at komme sig efter udsættelse for anti…
- Hvad er en gnagende planteet?
- Simuleringer viser nyt fænomen med nanopore DNA-sekventering
- At lave menstruationsbind af sukkulenter kan forbedre adgangen til hygiejneprodukter


