Hvilket element har en højere første ioniseringsenergi end klor CL?
Her er hvorfor:
* ioniseringsenergi: Mængden af energi, der kræves for at fjerne et elektron fra et neutralt gasformigt atom i sin jordtilstand.
* Tendenser i den periodiske tabel: Ioniseringsenergi øges generelt, når du bevæger dig:
* på tværs af en periode (venstre til højre): Dette skyldes, at den effektive atomafgift øges, at trække elektroner tættere på kernen og gøre dem sværere at fjerne.
* op en gruppe (top til bund): Dette skyldes, at de yderste elektroner er længere væk fra kernen og oplever mindre tiltrækning.
Da fluor er direkte over klor i den periodiske tabel (i den samme gruppe), har den en højere første ioniseringsenergi.
Sidste artikelHar svovl en lavere ioniseringsenergi end klor?
Næste artikelHvilke atomer har den samme kemiske egenskab som calcium?
 Varme artikler
Varme artikler
-
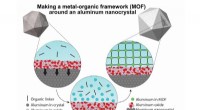 Forskere tilføjer porøs konvolut til aluminium plasmonicsEn grafik, der illustrerer syntesemetoden, der begynder med oxiddækkede aluminiumsnanokrystaller (øverst til venstre) og slutter med nanokrystallen indkapslet i metal-organisk ramme (MOF). MOFen samle
Forskere tilføjer porøs konvolut til aluminium plasmonicsEn grafik, der illustrerer syntesemetoden, der begynder med oxiddækkede aluminiumsnanokrystaller (øverst til venstre) og slutter med nanokrystallen indkapslet i metal-organisk ramme (MOF). MOFen samle -
 Forskere gør grøn kemi frem med ny katalysator til reduktion af kuldioxidKredit:CC0 Public Domain Forskere ved Oregon State University har gjort et vigtigt fremskridt i den grønne kemi stræben efter at omdanne drivhusgassen kuldioxid til genanvendelige former for kulst
Forskere gør grøn kemi frem med ny katalysator til reduktion af kuldioxidKredit:CC0 Public Domain Forskere ved Oregon State University har gjort et vigtigt fremskridt i den grønne kemi stræben efter at omdanne drivhusgassen kuldioxid til genanvendelige former for kulst -
 Acetone plus lys skaber et grønt jetbrændstoftilsætningsstofStartende med acetone afledt af planter, forskere ved Los Alamos omdanner dette simple molekyle til jetbrændstof ved hjælp af en ny proces, der bruger lys. Dette har potentiale til at blive blandet me
Acetone plus lys skaber et grønt jetbrændstoftilsætningsstofStartende med acetone afledt af planter, forskere ved Los Alamos omdanner dette simple molekyle til jetbrændstof ved hjælp af en ny proces, der bruger lys. Dette har potentiale til at blive blandet me -
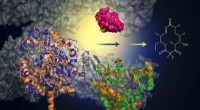 Forskere udvikler grønnere og mere effektiv metode til fremstilling af næste generations antibioti…Med tilføjelsen af en murin-afledt biokatalysator (grøn), kan dette konstruerede protein tilføje et fluoridatom for at skabe makrolidanaloger (struktur, til højre). Denne tilgang tilbyder en grønner
Forskere udvikler grønnere og mere effektiv metode til fremstilling af næste generations antibioti…Med tilføjelsen af en murin-afledt biokatalysator (grøn), kan dette konstruerede protein tilføje et fluoridatom for at skabe makrolidanaloger (struktur, til højre). Denne tilgang tilbyder en grønner
- Udfylde et vigtigt hul i klimamodeller
- Et eksempel på teknologi, der ofte bruges af videnskabsmand, er?
- Brændstoffer til arktisk spild kræver rystelse af den russiske minigigant
- Hvorfor blev det kaldt Jupiter?
- Mød NASAs dobbelte rumfartøj på vej til jordens ende
- Fusionsforskere forbereder sig på at lære, hvordan plasmaenergi udnyttes


