Hvad er den ioniske formel for blynitrat og kobbersulfat?
1. Identificer ionerne
* blynitrat:
* Bly (PB) danner en +2 ion (Pb²⁺).
* Nitrat (NO₃) er en polyatomisk ion med en -1 -ladning (NO₃⁻).
* kobbersulfat:
* Kobber (Cu) kan danne to almindelige ioner:cu⁺ (cuprous) og cu²⁺ (cupric). Vi antager den mere almindelige Cu²⁺ for dette eksempel.
* Sulfat (SO₄) er en polyatomisk ion med en -2 ladning (SO₄²⁻).
2. Balance anklagerne
* blynitrat: For at afbalancere ladningerne har vi brug for to nitrationer for hver blyion:Pb²⁺ + 2no₃⁻ → pb (no₃) ₂
* kobbersulfat: Anklagerne er allerede afbalanceret i et forhold på 1:1:Cu²⁺ + so₄²⁻ → cuso₄
Derfor er de ioniske formler:
* blynitrat:Pb (ingen₃) ₂
* kobbersulfat:cuso₄
Sidste artikelHvorfor reagerer elementært natrium og klor så let?
Næste artikelReagerer jod- og lithiumbromid?
 Varme artikler
Varme artikler
-
 Kemisk proces nedbryder lignin og gør birketræ til brugbare kemiske produkterDette billede viser den kemiske reaktor, der blev brugt i undersøgelsen til at spalte træ til træmasse og ligninolie. Kredit:KU Leuven Et team af forskere tilknyttet flere institutioner i Belgien
Kemisk proces nedbryder lignin og gør birketræ til brugbare kemiske produkterDette billede viser den kemiske reaktor, der blev brugt i undersøgelsen til at spalte træ til træmasse og ligninolie. Kredit:KU Leuven Et team af forskere tilknyttet flere institutioner i Belgien -
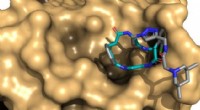 At lære af naturens gavmildhed:Nye biblioteker til lægemiddelopdagelseKunstnerisk skildring af en makrocyklus, der binder til et målprotein. Kredit:Billede:Universitetet i Basel, Basilius Sauter/CC BY-SA 3.0 Naturlige produkter, eller deres nære derivater, lave nogl
At lære af naturens gavmildhed:Nye biblioteker til lægemiddelopdagelseKunstnerisk skildring af en makrocyklus, der binder til et målprotein. Kredit:Billede:Universitetet i Basel, Basilius Sauter/CC BY-SA 3.0 Naturlige produkter, eller deres nære derivater, lave nogl -
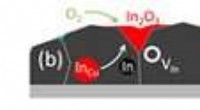 Spørgsmål og svar:Mod en ny måde at producere solceller påKredit:University of Luxembourg Fysikere fra University of Luxembourg sammen med internationale forskere har undersøgt oxidationsprocessen af solcellematerialer, hvis resultater kan ændre den nu
Spørgsmål og svar:Mod en ny måde at producere solceller påKredit:University of Luxembourg Fysikere fra University of Luxembourg sammen med internationale forskere har undersøgt oxidationsprocessen af solcellematerialer, hvis resultater kan ændre den nu -
 Russiske videnskabsmænd udvikler teknologi til produktion af gennemsigtigt aluminiumKredit:National Research Nuclear University Specialister fra National Research Nuclear University MEPhI og multi-institutionelle samarbejdspartnere har udviklet en teknologi til at producere kompa
Russiske videnskabsmænd udvikler teknologi til produktion af gennemsigtigt aluminiumKredit:National Research Nuclear University Specialister fra National Research Nuclear University MEPhI og multi-institutionelle samarbejdspartnere har udviklet en teknologi til at producere kompa
- Hvor meget energi tager det at lancere en raket månen?
- Det lykkes forskere at kontrollere spinbølger med ekstremt kort bølgelængde
- SNS afslutter fuld neutronproduktionscyklus på rekordhøjt effektniveau
- Sådan konverteres kvadratfod til lineær fod
- Hvad er Gutenberg Discontinuity?
- Hvor lang tid tager det for sort skimmel at dræbe dig?


