Hvilken type binding er aluminiumsbromid?
Her er hvorfor:
* Elektronegativitetsforskel: Aluminium (AL) er et metal med en lav elektronegativitet, mens brom (BR) er en ikke -metal med en høj elektronegativitet. Den signifikante forskel i elektronegativitet mellem de to elementer fører til overførsel af elektroner fra aluminium til brom.
* Dannelse af ioner: Aluminium mister tre elektroner for at blive en positivt ladet aluminiumion (AL 3+ ), mens brom får en elektron hver til dannelse af negativt ladede bromidioner (Br - ).
* Elektrostatisk attraktion: De modsatte ladede ioner holdes derefter sammen af stærke elektrostatiske kræfter og danner en ionisk binding.
Derfor er aluminiumbromid et klassisk eksempel på en ionisk forbindelse.
 Varme artikler
Varme artikler
-
 En ny katalysator til at bremse den globale opvarmningKredit:Shutterstock Russiske videnskabsmænd har udviklet en ny, højeffektiv katalysator til industriel forarbejdning af kuldioxid, der gør processen enkel og billig. Forskere fra MISIS University,
En ny katalysator til at bremse den globale opvarmningKredit:Shutterstock Russiske videnskabsmænd har udviklet en ny, højeffektiv katalysator til industriel forarbejdning af kuldioxid, der gør processen enkel og billig. Forskere fra MISIS University, -
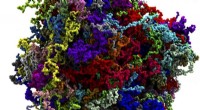 Mystiske cellulære dråber kommer i fokusIndividuelle proteinmolekyler, der udgør kondensatet, fremhæves med farve. Kredit:Han-Yi Chou, University of Illinois, Urbana-Champaign Verden inde i den menneskelige celle er blevet en smule mere
Mystiske cellulære dråber kommer i fokusIndividuelle proteinmolekyler, der udgør kondensatet, fremhæves med farve. Kredit:Han-Yi Chou, University of Illinois, Urbana-Champaign Verden inde i den menneskelige celle er blevet en smule mere -
 Forbedring af kvantecomputereKredit:CC0 Public Domain I årtier, eksperter har forudsagt, at kvantecomputere en dag vil udføre vanskelige opgaver, såsom simulering af komplekse kemiske systemer, det kan ikke lade sig gøre med
Forbedring af kvantecomputereKredit:CC0 Public Domain I årtier, eksperter har forudsagt, at kvantecomputere en dag vil udføre vanskelige opgaver, såsom simulering af komplekse kemiske systemer, det kan ikke lade sig gøre med -
 Molekyle egenskaber ændres gennem lysTobias Thomanek, Enrique Mendez Vega og Wolfram Sander (fra venstre). Ikke afbildet, men væsentligt involveret i undersøgelsen:Iris Trosien. Kredit:RUB, Marquard Inden for computerteknik, magnetis
Molekyle egenskaber ændres gennem lysTobias Thomanek, Enrique Mendez Vega og Wolfram Sander (fra venstre). Ikke afbildet, men væsentligt involveret i undersøgelsen:Iris Trosien. Kredit:RUB, Marquard Inden for computerteknik, magnetis
- Hvilken type energi er termodynamik studiet af?
- Hvad er vinkelhastigheden i radianer pr. Sekund af et hjul, der roterer ved O 18 o / min?
- Sådan beregnes kortslutningsbedømmelsen
- Vintræ-lignende CNT-arkitekturer
- Sådan fungerer din hjerne
- Miljøorganer berørt af nye britiske regeringers klimakommentarer


