Mystiske cellulære dråber kommer i fokus
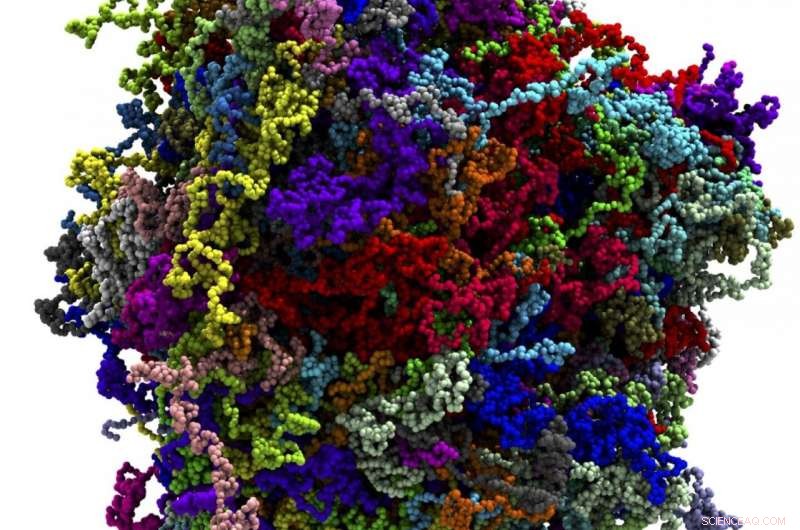
Individuelle proteinmolekyler, der udgør kondensatet, fremhæves med farve. Kredit:Han-Yi Chou, University of Illinois, Urbana-Champaign
Verden inde i den menneskelige celle er blevet en smule mere interessant i de senere år, efterhånden som en ny biologisk strukturs rolle blev tydeligere.
Det har længe været antaget, at de vigtigste operationer i cellen sker inden for organeller. "De er der for at udføre visse funktioner. F.eks. mitokondrier genererer den energi, som alting kører på, " forklarede Aleksei Aksimentiev, en professor i fysik ved University of Illinois i Urbana-Champaign. "Det, der er fælles for dem alle, er, at de er omgivet af en lipidmembran. Hvad folk for nylig har opdaget er, at der er organeller, der ikke har lipid-dobbeltlag. De samles spontant i form af dråber. Og disse organeller har særlige funktioner ."
I de seneste år, med forbedrede billedbehandlingsmuligheder, rollerne, Hændelse, og opførsel af disse membranløse organeller er blevet tydeligere. I 2017 fik de et navn:biologiske kondensater. De menes at spille en rolle i DNA-reparation og aldring, og forskere mener, at en række neurologiske sygdomme er relateret til, at kondensatet ikke fungerer korrekt, herunder amyotrofisk lateral sklerose, eller ALS, hvor nerveceller nedbrydes, fører til tab af muskelfunktion.
"Lad os sige, at du har DNA, og det pludselig har en pause. Det er normalt en rigtig dårlig ting, fordi det ikke kan replikere, men der er et maskineri, der vil komme og reparere det, " forklarede han. "Der dannes en boble af kondensat, som mirakuløst kun tiltrækker de molekyler, der er nødvendige for at reparere DNA'et. Der er alle mulige forskellige kondensater, og de rekrutterer alle de rigtige molekyler på en eller anden måde."
Hvordan dannes disse membranløse organeller spontant? Og hvordan rekrutterer de andre molekyler til at hjælpe dem?
Fysikken i denne proces ligner faseadskillelse, som hvordan olie og vand spontant danner dråber under de rigtige forhold, men med nogle forskelle. Ved normal faseadskillelse, temperatur motiverer normalt adskillelsen. I biologi, det er en ændring i koncentrationer.
"Vi ved ikke præcis, hvordan det fungerer, " sagde Aksimentiev. "Jeg er specielt interesseret i, hvordan denne rekruttering sker, og hvordan molekyler genkender andre molekyler."
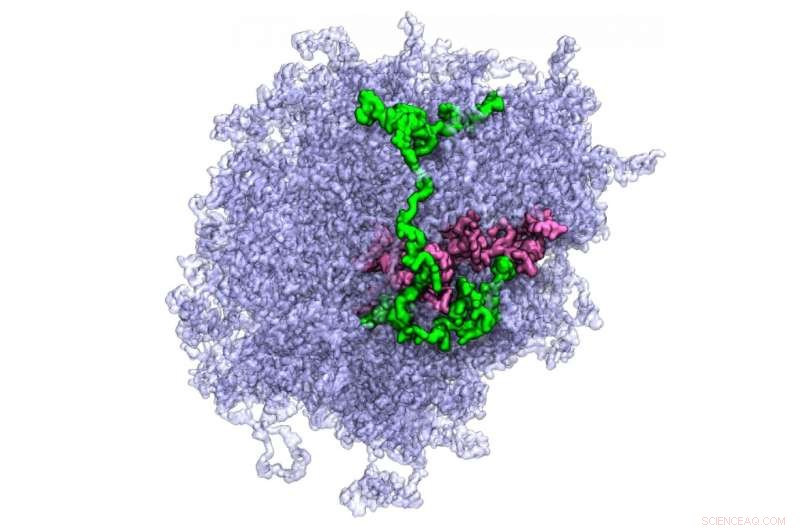
All-atom model af et biologisk kondensat. Individuelle proteinmolekyler, der udgør kondensatet, fremhæves med farve. Kredit:Swan Htun, University of Illinois, Urbana-Champaign
Aksimentiev bruger Frontera-supercomputeren på Texas Advanced Computing Center (TACC), en af de hurtigste i verden, for bedre at forstå denne proces. I løbet af det sidste årti, han og andre udviklede værktøjer og metoder til at udforske biologiske systemers adfærd på atomniveau ved hjælp af simuleringer af molekylær dynamik.
Aksimentiev er i stand til at simulere biologiske systemer med millioner af interagerende atomer i et realistisk miljø i mikrosekunder eller endda millisekunder - de tidsskalaer, hvor biologiske systemer fungerer. Dagens supercomputere tillader større, hurtigere simuleringer, og tillade videnskabsmænd at stille og besvare nye spørgsmål.
Selv efter feltets standarder, biologiske kondensater er udfordrende at studere beregningsmæssigt. I modsætning til andre ordnede systemer som proteiner med kendte stive strukturer, eller forstyrrede systemer som vand, biologiske kondensater er det, der er kendt som 'delvist uordnede' - en særlig svær type struktur at simulere.
Skrivning i Journal of Physical Chemistry Letters i maj 2020, Aksimentiev og kandidatstuderende Han-Yi Chou beskrev grovkornede molekylær dynamik-simuleringer på Frontera, der kortlagde fasediagrammet (en grafisk repræsentation af et stofs fysiske tilstande under forskellige temperatur- og trykforhold) af et bestemt biomolekylært kondensat - sammensmeltet i sarkom (FUS). Et nuklear DNA/RNA bindende protein, FUS regulerer forskellige trin af genekspression, inklusive transskription, splejsning og mRNA-transport. Forskningen blev støttet af tilskud fra National Science Foundation og National Institutes of Health.
Forskerne viste, at en partikelbaseret molekylær dynamikmodel kan reproducere kendte faseadskillelsesegenskaber for et FUS-kondensat, herunder dens kritiske koncentration og modtagelighed for mutationer.
De viste også, at de kunne bruge kædekollapsteori til at bestemme kondensatets termodynamiske egenskaber og forbinde dem med ændringer i formen af individuelle kondensatmolekyler.
Opførsel af et biologisk kondensat, med alle dets komplekse inter- og intramolekylære interaktioner, kan beskrives ved en polymerfysikmodel, de fandt. Dette gør computermodellering til et nyttigt værktøj til at afdække adfærden hos disse stadig mystiske cellulære skuespillere.
Aksimentievs forskning sætter scenen for fremtidige undersøgelser, der vil belyse de molekylære mekanismer, der driver dannelsen af dråber i mere komplekse biologiske kondensater, som dem, der reparerer RNA. Værket er et skridt på en lang vej for fuldt ud at belyse mysteriet om biologiske kondensater i celler - endnu et naturtrick, der langsomt afsløres.
 Varme artikler
Varme artikler
-
 De miljømæssige omkostninger ved kontaktlinserKontaktlinser genvundet fra behandlet spildevandsslam kan skade miljøet. Kredit:Charles Rolsky Mange mennesker er afhængige af kontaktlinser for at forbedre deres syn. Men disse synskorrigerende e
De miljømæssige omkostninger ved kontaktlinserKontaktlinser genvundet fra behandlet spildevandsslam kan skade miljøet. Kredit:Charles Rolsky Mange mennesker er afhængige af kontaktlinser for at forbedre deres syn. Men disse synskorrigerende e -
 Organisk fotovoltaisk celle med 17% effektivitet og overlegen bearbejdelighed til belægning i stort…(a) Molekylære strukturer af PBDB-TF og BTP-4Cl-X, X repræsenterer 8, 12 eller 16. b) statistik over OPV -celle under forskellige forberedelsesbetingelser. Kredit:Science China Press Organiske fot
Organisk fotovoltaisk celle med 17% effektivitet og overlegen bearbejdelighed til belægning i stort…(a) Molekylære strukturer af PBDB-TF og BTP-4Cl-X, X repræsenterer 8, 12 eller 16. b) statistik over OPV -celle under forskellige forberedelsesbetingelser. Kredit:Science China Press Organiske fot -
 Mellemlag hjælper perovskitkrystallisering til højtydende lysemitterende dioderForskellige metaloxidlag påvirker egenskaberne af de tynde perovskitfilm. Kredit:Charlotte Perhammar Forskere ved LiU, der arbejder med kolleger fra Kina, har vist, hvordan man opnår effektive per
Mellemlag hjælper perovskitkrystallisering til højtydende lysemitterende dioderForskellige metaloxidlag påvirker egenskaberne af de tynde perovskitfilm. Kredit:Charlotte Perhammar Forskere ved LiU, der arbejder med kolleger fra Kina, har vist, hvordan man opnår effektive per -
 Forskere leverer højopløsnings glimt af enzymstrukturVed hjælp af en state-of-the-art type elektronmikroskopi, et MIT-ledet hold har opdaget strukturen af et enzym, der er afgørende for at opretholde en tilstrækkelig forsyning af DNA-byggesten i menne
Forskere leverer højopløsnings glimt af enzymstrukturVed hjælp af en state-of-the-art type elektronmikroskopi, et MIT-ledet hold har opdaget strukturen af et enzym, der er afgørende for at opretholde en tilstrækkelig forsyning af DNA-byggesten i menne


