Forskere leverer højopløsnings glimt af enzymstruktur
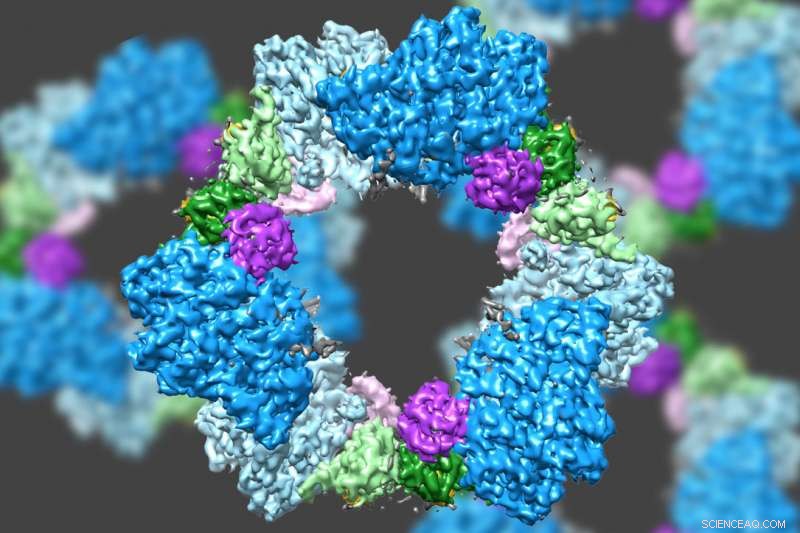
Ved hjælp af en state-of-the-art type elektronmikroskopi, et MIT-ledet hold har opdaget strukturen af et enzym, der er afgørende for at opretholde en tilstrækkelig forsyning af DNA-byggesten i menneskelige celler. Kredit:Massachusetts Institute of Technology
Ved hjælp af en state-of-the-art type elektronmikroskopi, et MIT-ledet hold har opdaget strukturen af et enzym, der er afgørende for at opretholde en tilstrækkelig forsyning af DNA-byggesten i menneskelige celler.
Deres nye struktur afslører også den sandsynlige mekanisme for, hvordan celler regulerer enzymet, kendt som ribonukleotidreduktase (RNR). Væsentligt, mekanismen ser ud til at adskille sig fra den bakterielle version af enzymet, tyder på, at det kunne være muligt at designe antibiotika, der selektivt blokerer det bakterielle enzym.
"Folk har forsøgt at finde ud af, om der er noget anderledes nok til, at du kunne hæmme bakterielle enzymer og ikke den menneskelige version, " siger Catherine Drennan, en MIT-professor i kemi og biologi og en Howard Hughes Medical Institute Investigator. "Ved at overveje disse nøgleenzymer og finde ud af, hvad der er forskelle og ligheder, vi kan se, om der er noget i det bakterielle enzym, der kan målrettes med småmolekylære lægemidler."
Drennan er en af de ledende forfattere af undersøgelsen, som optræder i tidsskriftets 20. februar-udgave eLife . Joanne Stubbe, Novartis professor i kemi Emerita ved MIT, og Francisco Asturias, en lektor i biokemi ved University of Colorado School of Medicine, er også seniorforfattere. Artiklens hovedforfattere er MIT-forsker Edward Brignole og tidligere Scripps Research Institute postdoc Kuang-Lei Tsai, som nu er assisterende professor ved University of Texas Houston Medical Center.
Et usædvanligt enzym
RNR enzymet, som findes i alle levende celler, omdanner ribonukleotider (byggestenene i RNA) til deoxyribonukleotider (byggestenene i DNA). Celler skal have et tilstrækkeligt lager af disse byggesten, men når de akkumulerer for mange, RNR er lukket af et deoxynukleotidmolekyle kendt som dATP. Når der er behov for flere deoxynukleotider, et beslægtet molekyle kaldet ATP binder til RNR og tænder det igen.
Et usædvanligt træk ved RNR er, at det kan katalysere produktionen af fire forskellige produkter:nukleotidbaserne ofte forkortet som A, G, C, og T. I 2016, Drennan opdagede, at enzymet opnår dette ved at ændre sin form som reaktion på regulatoriske molekyler.
De fleste af forskernes tidligere arbejde med RNR-struktur har fokuseret på den version, der findes i E coli . For disse undersøgelser, de brugte røntgenkrystallografi, en teknik, der kan afsløre den atomare og molekylære struktur af et protein, efter at det er blevet krystalliseret.
I den nye undersøgelse, Drennan og hendes kolleger satte sig for at undersøge den menneskelige version af RNR. Dette proteins struktur, som viste sig at være meget forskellig fra den bakterielle version, viste sig at være uhåndgribelig ved hjælp af røntgenkrystallografi, som ikke fungerer godt for proteiner, der ikke let krystalliserer. I stedet, forskerne henvendte sig til en avanceret form for mikroskopi kendt som kryo-elektronmikroskopi (cryo-EM).
Indtil for nylig, cryo-EM tilbød typisk opløsning på omkring 10 til 20 ångstrøm, som måske afslører den overordnede form af et protein, men ingen detaljer om placeringen og formen af mindre strukturelle enheder i det. Imidlertid, i de seneste år, teknologiske fremskridt har ført til en eksplosion i antallet af strukturer, der opnår opløsninger på omkring 3 ångstrøm. Det er højt nok til at spore individuelle proteinkæder i det større molekyle, samt interne strukturer såsom helixer og endda sidekæder af aminosyrer.
Forskere vidste allerede, at RNR består af to proteinunderenheder kendt som alfa og beta. Ved hjælp af cryo-EM, MIT-holdet fandt ud af, at den menneskelige version af enzymet danner en ring lavet af seks af alfa-underenhederne. Når ATP, som aktiverer RNR, er bundet til enzymet, ringen er ustabil og kan let åbnes, lader beta-underenheden komme ind i ringen. Denne sammenføjning af alfa og beta tillader enzymets aktive sted, placeret i beta-underenheden, at udføre de kemiske reaktioner, der er nødvendige for at producere deoxynukleotider.
Imidlertid, når inhibitoren dATP er til stede, ringen bliver meget mere stiv og tillader ikke beta-underenheden at komme ind. Dette forhindrer enzymet i at katalysere produktionen af deoxynukleotider.
Design af lægemidler
Adskillige kræftlægemidler, der nu er i brug eller under udvikling, retter sig mod den menneskelige version af RNR, forstyrre kræftcellernes evne til at reproducere ved at begrænse deres udbud af DNA-byggesten. MIT-holdet har fundet beviser for, at mindst et af disse lægemidler, clofarabin diphosphat, virker ved at inducere dannelsen af stive 6-enheds alfa-ringe.
Denne 6-enhedsring findes ikke i bakterieformen af RNR, som i stedet samles til en særskilt ring indeholdende fire alfa-underenheder og fire beta-underenheder. Det betyder, at det kunne være muligt at designe antibiotika, der retter sig mod den bakterielle version, men ikke den menneskelige version, Drennan siger.
Hun planlægger nu at undersøge strukturerne af andre proteinmolekyler, der er svære at studere med røntgenkrystallografi, herunder proteiner med jernsvovlklynger, som findes i mange metaboliske veje. Mikroskopiarbejdet i denne undersøgelse blev udført på Scripps Research Institute, men når MITs nye MIT.nano-bygning åbner, det vil rumme to kryo-EM-mikroskoper, der vil være tilgængelige for MIT-samfundet såvel som andre potentielle brugere i industrien og den akademiske verden.
"De teknologiske fremskridt, der har gjort det muligt for cryo-EM at nå så høj opløsning, er virkelig spændende, Drennan siger. "Det er virkelig begyndt at revolutionere studiet af biologi."
 Varme artikler
Varme artikler
-
 Røntgenbilleder giver fingerpeg om brud i solid-state batterierMatthew McDowell, en assisterende professor ved George W. Woodruff School of Mechanical Engineering og School of Materials Science and Engineering, undersøger batterier i en cykelstation. Kredit:Rob F
Røntgenbilleder giver fingerpeg om brud i solid-state batterierMatthew McDowell, en assisterende professor ved George W. Woodruff School of Mechanical Engineering og School of Materials Science and Engineering, undersøger batterier i en cykelstation. Kredit:Rob F -
 Video:Hvorfor er vestkysten himmelorange?Kredit:The American Chemical Society Californiens skovbrande er, desværre, intet nyt - men det er den lyse orange himmel bestemt. Denne uge om reaktioner, vi taler med eksperter, der forklarer år
Video:Hvorfor er vestkysten himmelorange?Kredit:The American Chemical Society Californiens skovbrande er, desværre, intet nyt - men det er den lyse orange himmel bestemt. Denne uge om reaktioner, vi taler med eksperter, der forklarer år -
 Gør havvand drikkeligt på få minutterSkematisk oversigt over koaksial elektrospinning. Kredit:Elsevier Ifølge Verdenssundhedsorganisationen omkring 785 millioner mennesker rundt om i verden mangler en ren drikkevandskilde. På trods a
Gør havvand drikkeligt på få minutterSkematisk oversigt over koaksial elektrospinning. Kredit:Elsevier Ifølge Verdenssundhedsorganisationen omkring 785 millioner mennesker rundt om i verden mangler en ren drikkevandskilde. På trods a -
 Glatte væskeoverflader forvirrer muslingerBilledet viser koloniseringen af et fast substrat i tidevandszonen af den californiske musling ( Mytilus californianus ) samt smykker og en søstjerne. Den nye belægning, der er beskrevet i denne
Glatte væskeoverflader forvirrer muslingerBilledet viser koloniseringen af et fast substrat i tidevandszonen af den californiske musling ( Mytilus californianus ) samt smykker og en søstjerne. Den nye belægning, der er beskrevet i denne
- Dynamiske katalysatorer til ren luft i byen
- Dybtgående ændringer er undervejs i jordens oceaner og is:Diskussion af IPCC-rapport af en klimafo…
- Forskere fremskynder indsatsen for at håndtere parasitiske rundorme
- I den nedværdigende natur skader menneskeheden sig selv, FN-rapport advarer
- Navngiv tre typer asexuel reproduktion
- Opdaget:Den tidligst kendte almindelige genetiske tilstand i menneskelig evolution


