Hvordan danner svovl sin ion?
* Elektronkonfiguration: Svovl har 16 elektroner med følgende elektronkonfiguration:1S² 2S² 2P⁶ 3S² 3P⁴. Dette betyder, at dens yderste skal (den tredje skal) har 6 elektroner, men den kan holde op til 8 elektroner for stabilitet.
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil oktet (8 elektroner) i deres yderste skal.
* iondannelse: Svovl opnår en stabil oktet ved at få to elektroner, hvilket gør sin elektronkonfiguration 1S² 2S² 2P⁶ 3S² 3p⁶.
* anion: Da svovl får elektroner, bliver det negativt ladet. Dette resulterer i sulfidion (s²⁻).
Kortfattet:
Svovl danner sin ion (S²⁻) ved at få to elektroner for at opnå en stabil octet i sin yderste skal, hvilket gør den til en anion med en -2 ladning.
Sidste artikelEr isvand et sammensat element eller en blanding?
Næste artikelHvordan tilbereder du 0,25N natriumhydroxid?
 Varme artikler
Varme artikler
-
 Processen fjerner samtidigt giftige metaller og salt for at producere rent vandEn fleksibel polymermembran, der indeholder nanopartikler af PAF, absorberer selektivt næsten 100% af metaller såsom kviksølv, kobber eller jern under afsaltning, mere effektivt at producere ren, sikk
Processen fjerner samtidigt giftige metaller og salt for at producere rent vandEn fleksibel polymermembran, der indeholder nanopartikler af PAF, absorberer selektivt næsten 100% af metaller såsom kviksølv, kobber eller jern under afsaltning, mere effektivt at producere ren, sikk -
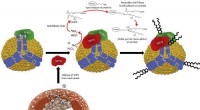 Potentiel beskyttelse mod åreforkalkningFigur 1. Skematisk af PON1/MPO-interaktion med apoA-I på HDL og produktionen af IsoLG. Aktiverede neutrofiler på stedet for aterosklerotiske læsioner frigiver MPO, som forbinder med cirkulerende HDL
Potentiel beskyttelse mod åreforkalkningFigur 1. Skematisk af PON1/MPO-interaktion med apoA-I på HDL og produktionen af IsoLG. Aktiverede neutrofiler på stedet for aterosklerotiske læsioner frigiver MPO, som forbinder med cirkulerende HDL -
 Akemikere udnytter solen til at genbruge plastikaffaldKredit:Pixabay/CC0 Public Domain Kemikere ved Cornell University har opdaget en måde at bruge lys og ilt til at opgradere polystyren - en type plastik, der findes i mange almindelige genstande - ti
Akemikere udnytter solen til at genbruge plastikaffaldKredit:Pixabay/CC0 Public Domain Kemikere ved Cornell University har opdaget en måde at bruge lys og ilt til at opgradere polystyren - en type plastik, der findes i mange almindelige genstande - ti -
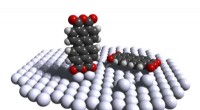 Tricky feat med stand-up molekyleOprejst PTCDA -molekyle på en sølvplatform (til venstre); normalt aflejres molekylet fladt mod det flade lag af sølvatomer (til højre). Kredit:Forschungszentrum Jülich / T. Esat I de seneste årtie
Tricky feat med stand-up molekyleOprejst PTCDA -molekyle på en sølvplatform (til venstre); normalt aflejres molekylet fladt mod det flade lag af sølvatomer (til højre). Kredit:Forschungszentrum Jülich / T. Esat I de seneste årtie
- Afstand af alle planeter fra solen i det indiske stedværdisystem?
- Stanford-fysiker foreslår at lede efter mørkt stof på usædvanlige steder
- Tøjvaskemidler og forurening
- Hvor almindelig er Xenon i naturen?
- Vedligeholder det amerikanske militær hemmelige undervandsbaser?
- Hvordan adskiller sejt tidevand sig fra lavvande?


