Hvorfor er smeltepunkterne af natriumchlorid og jod meget forskellige?
natriumchlorid (NaCl):
* ionisk binding: NaCl består af en stærk ionisk binding mellem positivt ladede natriumioner (Na⁺) og negativt ladede chloridioner (CL⁻). Disse ioner er arrangeret i en krystalgitterstruktur.
* højt smeltepunkt: De elektrostatiske kræfter til tiltrækning mellem de modsatte ladede ioner er meget stærke. For at smelte NaCl skal du overvinde disse stærke kræfter og kræve en masse energi. Dette forklarer dets høje smeltepunkt på 801 ° C.
jod (i₂):
* kovalent binding: Jod findes som diatomiske molekyler (I₂) holdt sammen af svage intermolekylære kræfter kendt som van der Waals -kræfter. Disse kræfter stammer fra midlertidige udsving i elektronfordeling.
* lavt smeltepunkt: Van der Waals -styrkerne er meget svagere end de ioniske bindinger i NaCl. Derfor er der behov for mindre energi for at overvinde disse kræfter og adskille jodmolekylerne, hvilket resulterer i et lavt smeltepunkt på 113,7 ° C.
Kortfattet:
* stærke ioniske bindinger: Højt smeltepunkt (NaCl)
* svage van der Waals Forces: Lavt smeltepunkt (i₂)
 Varme artikler
Varme artikler
-
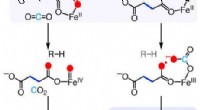 Vejen til fremstilling af ethylenMekanismer for de ethylen-dannende enzym (EFE) reaktioner. Ny forskning beskriver de kemiske trin, som dette naturligt forekommende enzym bruger til at omdanne en almindelig kemisk forbindelse til eth
Vejen til fremstilling af ethylenMekanismer for de ethylen-dannende enzym (EFE) reaktioner. Ny forskning beskriver de kemiske trin, som dette naturligt forekommende enzym bruger til at omdanne en almindelig kemisk forbindelse til eth -
 Gør ammoniak grønnereGrafisk illustration, der viser protoneret vand, der reagerer med nitrogenmolekyler for at danne ammoniak ved en plasma-væske-grænseflade. Kredit:Case Western Reserve University Ammoniak, en forbi
Gør ammoniak grønnereGrafisk illustration, der viser protoneret vand, der reagerer med nitrogenmolekyler for at danne ammoniak ved en plasma-væske-grænseflade. Kredit:Case Western Reserve University Ammoniak, en forbi -
 Ny proteinbilleddannelsesmetode baner vej for næste generations biomaterialer og vævsanalyseKredit:Unsplash/CC0 Public Domain Forskere har etableret en ny metode til billedproteiner, der kan føre til nye opdagelser i sygdomme gennem biologisk vævs- og celleanalyse og udvikling af nye bio
Ny proteinbilleddannelsesmetode baner vej for næste generations biomaterialer og vævsanalyseKredit:Unsplash/CC0 Public Domain Forskere har etableret en ny metode til billedproteiner, der kan føre til nye opdagelser i sygdomme gennem biologisk vævs- og celleanalyse og udvikling af nye bio -
 Fremstilling af stof af træKredit:Janko Ferlic Som et materiale har træ mange anvendelsesmuligheder, men vidste du, at det kan bruges til at lave fibre til tøj og andre tekstiler? Måske overraskende, det er råmaterialet i n
Fremstilling af stof af træKredit:Janko Ferlic Som et materiale har træ mange anvendelsesmuligheder, men vidste du, at det kan bruges til at lave fibre til tøj og andre tekstiler? Måske overraskende, det er råmaterialet i n
- Hvilken beskriver bedst DNA-strukturen?
- 'Strained' kvanteprikker viser nye optiske egenskaber
- Hvad er racetræthed? En skolepsykolog forklarer
- Mød AFM: Den forbløffende nye sygdom Nogle læger kalder "den nye polio"
- Hvad gør de syv processer i livet?
- Cirkler Jorden om Solen i sin bane omkring solsystemet?


