Vejen til fremstilling af ethylen
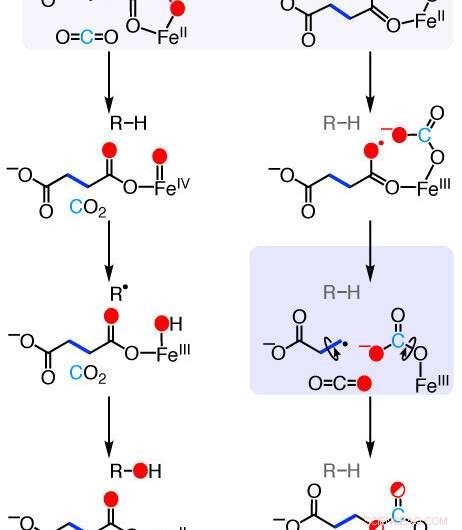
Mekanismer for de ethylen-dannende enzym (EFE) reaktioner. Ny forskning beskriver de kemiske trin, som dette naturligt forekommende enzym bruger til at omdanne en almindelig kemisk forbindelse til ethylen - et plantehormon, der er vigtigt for frugtmodning, og et industrielt kemikalie, der bruges til fremstilling af plastik og tekstiler. Kredit:Rachelle Copeland, Penn State
Ny forskning beskriver de kemiske trin, som et naturligt forekommende enzym bruger til at omdanne en almindelig kemisk forbindelse til ethylen - et plantehormon, der er vigtigt for frugtmodning, og et industrielt kemikalie, der bruges til fremstilling af plastik og tekstiler. Et papir, der beskriver forskningen udført af videnskabsmænd ved Penn State, vises online den 12. august i tidsskriftet Videnskab .
"Fordi ethylen er så vigtigt i fremstillingsindustrien til fremstilling af plastik, opløsningsmidler og tekstiler, det er en af de mest producerede forbindelser på Jorden, " sagde Rachelle Copeland, en nyligt ph.d.-kandidat fra Penn State og første og medkorresponderende forfatter til papiret. "I øjeblikket, petroleum er vores vigtigste kilde til ethylen til disse formål. Imidlertid, planter og nogle mikrober producerer naturligt ethylen. At forstå den trinvise kemiske proces, der bruges af disse planter og mikrober, kan hjælpe os med at bevæge os væk fra oliebaseret ethylenproduktion."
Det passende navngivne "ethylen-dannende enzym (EFE)" er i stand til at transformere en almindelig kemisk forbindelse - 2-oxoglutarat, som findes i næsten alle organismer, hvor det spiller en rolle i stofskiftet - til ethylen, men forskerne havde ikke været i stand til præcist at karakterisere den mekanisme, som enzymet anvendte. Den reaktion, der kræves til denne transformation, er fundamentalt forskellig fra reaktioner drevet af enzymer, der er tæt beslægtet med EFE.
Enzymer er proteiner, der igangsætter eller fremskynder de kemiske reaktioner, der er nødvendige for at opretholde liv, hvoraf de fleste kræver atomer, klynger af atomer, eller små molekyler - samlet kendt som cofaktorer - for at få disse reaktioner til at ske. EFE tilhører en klasse af enzymer, der fremmer reaktioner af forskellige typer molekyler med oxygen, aktiveret af en jerncofaktor og 2-oxoglutarat co-substrat.
"Vores laboratoriegruppe har studeret enzymer relateret til EFE i næsten 20 år, sagde Carsten Krebs, professor i kemi og i biokemi og molekylærbiologi ved Penn State og forfatter til papiret. "EFE er unikt blandt denne familie af enzymer, fordi det nedbryder 2-oxoglutarat på to forskellige måder. Den første er velkarakteriseret, men den anden, den, der producerer ethylen, har været et mysterium indtil nu."
Forskerholdet dissekerede den kemiske vej for ethylendannelse ved EFE ved at indsætte isotoper - atomer, der adskiller sig i atomvægt og kan spores, mens reaktionen er i gang - i de forskellige produkter. På denne måde kunne holdet spore individuelle atomer for at se, hvor de går hen i løbet af reaktionen. Separat, de lavede også kemiske modifikationer af både enzymet og 2-oxoglutaratet for at se, hvordan reaktionen og produkterne blev ændret.
"Ved at bruge disse teknikker, vi kunne se, at EFE initierer reaktionen mellem 2-oxoglutarat og oxygen på en meget anderledes måde end andre relaterede enzymer, " sagde Copeland. "Det indsætter ilten mellem to carbonatomer af 2-oxoglutarat, som producerer en unik mellemforbindelse, som enzymet derefter nedbryder til ethylen."
Placeringen af det indsatte oxygenatom var blevet forudsagt beregningsmæssigt, men var ikke blevet vist eksperimentelt indtil nu.
"Der har været foreslået adskillige mekanismer gennem årene for at forklare, hvordan EFE omdanner 2-oxoglutarat til ethylen, men der har ikke været nogen eksperimentelle data til at skelne mellem dem, " sagde J. Martin Bollinger Jr., professor i kemi og i biokemi og molekylærbiologi ved Penn State og forfatter til papiret. "Rachelle designede disse eksperimenter for at se på de mest fundamentale aspekter af reaktionen. Hvor går de enkelte atomer hen? Og det kortlægger en umiskendelig klar mekanisme."
 Varme artikler
Varme artikler
-
 Morgendagens datahukommelser:Brug af ny teknologi til at udforske enkeltmolekylemagneter i slowmotio…Lena Scherthan er den første forfatter til den aktuelle undersøgelse. Kredit:Koziel/TUK Ved lagring af data, konventionelle teknikker når i stigende grad deres grænser. Såkaldte enkeltmolekylemagn
Morgendagens datahukommelser:Brug af ny teknologi til at udforske enkeltmolekylemagneter i slowmotio…Lena Scherthan er den første forfatter til den aktuelle undersøgelse. Kredit:Koziel/TUK Ved lagring af data, konventionelle teknikker når i stigende grad deres grænser. Såkaldte enkeltmolekylemagn -
 Ny undersøgelse foreslår en lav pris, højeffektiv maskedesignKredit:CC0 Public Domain Et nyt papir ind Oxford Open Materials Science præsenterer billige modifikationer til eksisterende N95-masker, der forlænger deres effektivitet og forbedrer deres genanv
Ny undersøgelse foreslår en lav pris, højeffektiv maskedesignKredit:CC0 Public Domain Et nyt papir ind Oxford Open Materials Science præsenterer billige modifikationer til eksisterende N95-masker, der forlænger deres effektivitet og forbedrer deres genanv -
 Brugereksperiment hos BESSY II—komplekse tesselleringer, ekstraordinære materialerDen nye byggeklods (venstre, rødt omrids) omfatter to modificerede startmolekyler forbundet med hinanden med et sølvatom (blåt). Dette fører til komplekse, semiregulære tesseller (højre, mikroskopbill
Brugereksperiment hos BESSY II—komplekse tesselleringer, ekstraordinære materialerDen nye byggeklods (venstre, rødt omrids) omfatter to modificerede startmolekyler forbundet med hinanden med et sølvatom (blåt). Dette fører til komplekse, semiregulære tesseller (højre, mikroskopbill -
 Forskning afdækker manglende fysik i eksplosive hotspotsMolekylær dynamik simuleringer forudsiger, at mere potentiel energi er lokaliseret i hotspots, end deres kinetiske energi (eller temperatur) antyder. Overskydende potentiel energi er bundet til vedvar
Forskning afdækker manglende fysik i eksplosive hotspotsMolekylær dynamik simuleringer forudsiger, at mere potentiel energi er lokaliseret i hotspots, end deres kinetiske energi (eller temperatur) antyder. Overskydende potentiel energi er bundet til vedvar
- Sådan sætter du ambitiøse mål for bæredygtigt landbrug
- Observationer af Rydberg exciton polaritoner og deres kondensat i et perovskithulrum
- Virus hamrer forretningsrejser, da forsigtige virksomheder ikke rejser
- Kunne computere hjælpe med at lukke partiske skel?
- Undervisning på engelsk ser ikke ud til at have nogen negativ indvirkning på svenske elever
- American Airlines ansøger om 12 mia. USD i statsstøtte


