Hvad sker der med atomer eller molekyler, når gas bliver flydende?
* nedsat afstand: Atomer eller molekyler i en gas er langt fra hinanden og bevæger sig frit. Når gassen kondenseres til en væske, bliver de attraktive kræfter mellem partiklerne stærke nok til at trække dem tættere sammen. Dette reducerer den gennemsnitlige afstand mellem dem markant.
* reduceret kinetisk energi: Molekylerne i en gas har høj kinetisk energi, som giver dem mulighed for at bevæge sig hurtigt og overvinde de attraktive kræfter mellem dem. Når gassen kondenseres, mister molekylerne kinetisk energi og bremser deres bevægelse.
* øget densitet: Når molekylerne kommer tættere sammen, falder volumenet, der er optaget af stoffet,, hvilket fører til en betydelig stigning i densitet.
* Tab af definerbar form: I modsætning til gasser tager væsker formen på deres beholder. Dette skyldes, at de attraktive kræfter mellem molekylerne er stærke nok til at holde dem sammen, men ikke stærke nok til at låse dem i en stiv struktur.
* øgede intermolekylære kræfter: De attraktive kræfter mellem molekylerne i en væske, kaldet intermolekylære kræfter, bliver stærkere end molekylernes kinetiske energi, hvilket får dem til at forblive tættere sammen. Det er det, der adskiller en væske fra en gas.
Tænk på det sådan: Forestil dig et værelse fuld af mennesker, der bevæger sig frit (gas). Hvis du begynder at presse dem ind i et mindre rum (mindske temperaturen eller øge trykket), kommer de tættere sammen (øget densitet), bevæger sig mindre (reduceret kinetisk energi) og forbliver i et mere begrænset rum (tab af definerbar form).
De specifikke ændringer, der sker, afhænger af typen af gas og betingelserne for overgangen. Imidlertid forbliver de generelle principper for nærhed, reduceret kinetisk energi og stærkere intermolekylære kræfter konsistente.
 Varme artikler
Varme artikler
-
 Programmerbare syntetiske materialerStænger med multivariate MOFer (til venstre) kan programmeres med forskellige metalatomer (farvede kugler) til at udføre en række kemiske opgaver, såsom kontrolleret frigivelse af lægemidler, eller ti
Programmerbare syntetiske materialerStænger med multivariate MOFer (til venstre) kan programmeres med forskellige metalatomer (farvede kugler) til at udføre en række kemiske opgaver, såsom kontrolleret frigivelse af lægemidler, eller ti -
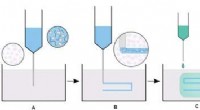 Ny 3-D printteknik til biomaterialerEt skema, der viser produktionen af et 3D bioprintet stillads ved brug af SLAM. A) Væskegel-printlejet skabes ved forskydningsafkøling af en varm agaroseopløsning gennem sol-gel-overgangen, som dere
Ny 3-D printteknik til biomaterialerEt skema, der viser produktionen af et 3D bioprintet stillads ved brug af SLAM. A) Væskegel-printlejet skabes ved forskydningsafkøling af en varm agaroseopløsning gennem sol-gel-overgangen, som dere -
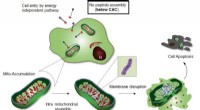 Forskere finder en ny måde at tackle kræftceller påFigur viser Intra-mitokondriel samling af Mito-FF. Kredit:UNIST Montering på stedet af amfifile peptider med ledsagende cellulære funktioner inde i en levende celle (dvs. intracellulær samling) og
Forskere finder en ny måde at tackle kræftceller påFigur viser Intra-mitokondriel samling af Mito-FF. Kredit:UNIST Montering på stedet af amfifile peptider med ledsagende cellulære funktioner inde i en levende celle (dvs. intracellulær samling) og -
 AI-drevet elektronisk næse til at opsnuse kødets friskhedE-næsen indeholder en stregkode, der ændrer farve på grund af reaktioner med gasser, der udsendes af det henfaldende kød, og en stregkodelæser i form af en smartphone-app drevet af AI, og er blevet tr
AI-drevet elektronisk næse til at opsnuse kødets friskhedE-næsen indeholder en stregkode, der ændrer farve på grund af reaktioner med gasser, der udsendes af det henfaldende kød, og en stregkodelæser i form af en smartphone-app drevet af AI, og er blevet tr


