Forskere finder en ny måde at tackle kræftceller på
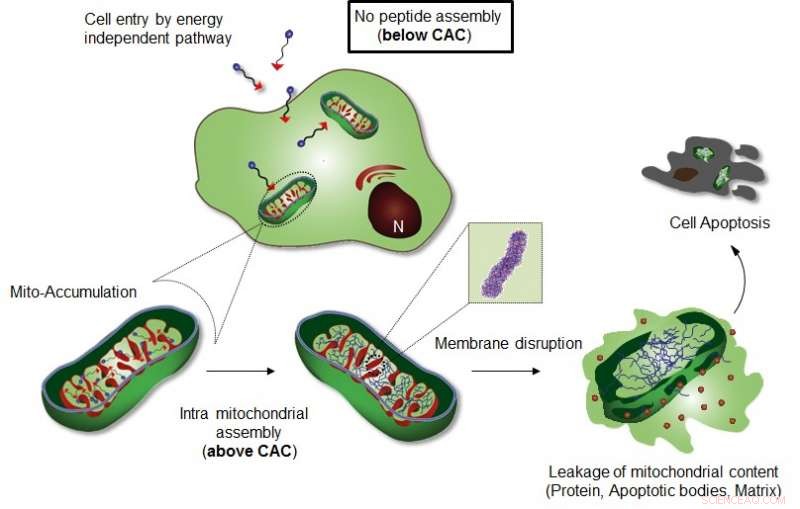
Figur viser Intra-mitokondriel samling af Mito-FF. Kredit:UNIST
Montering på stedet af amfifile peptider med ledsagende cellulære funktioner inde i en levende celle (dvs. intracellulær samling) og deres interaktion med cellulære komponenter er dukket op som en alsidig strategi til styring af cellulær skæbne. Imidlertid, opnå spatiotemporal kontrol (dvs. inde i cellulære organeller eller andre underrum) over selvsamling af syntetiske molekyler inde i cellen er udfordrende på grund af vanskeligheden ved at studere deres adfærd i det komplekse intracellulære miljø.
En nylig undersøgelse, tilknyttet UNIST har udviklet en ny metode til at målrette mitokondrier i en kræftcelle. Forskergruppen forventer, at deres undersøgelse kan bane vej for en ny generation af kræftbekæmpende lægemidler.
Denne forskning er blevet ledet af professor Ja-Hyoung Ryu i kemi ved UNIST i samarbejde med Sang Kyu Kwak fra Energy and Chemical Engineering ved UNIST og professor Eunji Lee fra Graduate School of Analytical Science and Technology ved Chungam National University. Resultaterne af undersøgelsen er blevet vist i den 21. april udgave af Naturkommunikation.
I undersøgelsen, det fælles forskerhold har indført, for første gang, den organellokaliserede selvsamling af et peptidamfifil som en kraftfuld strategi til styring af cellulær skæbne.
Selvmontering er en ligevægtsproces mellem de enkelte byggeenheder og deres aggregerede tilstand, og koncentrationen af molekylerne skal være over den kritiske værdi for at fremkalde samling (dvs. den kritiske aggregeringskoncentration (CAC). I levende celler, opnåelse af CAC er også påkrævet for at danne samlinger af individuelle molekyler, men har en begrænsning, fordi den kemiske kompleksitet i cellulære miljøer forstyrrer interaktioner mellem syntetiske byggeenheder.
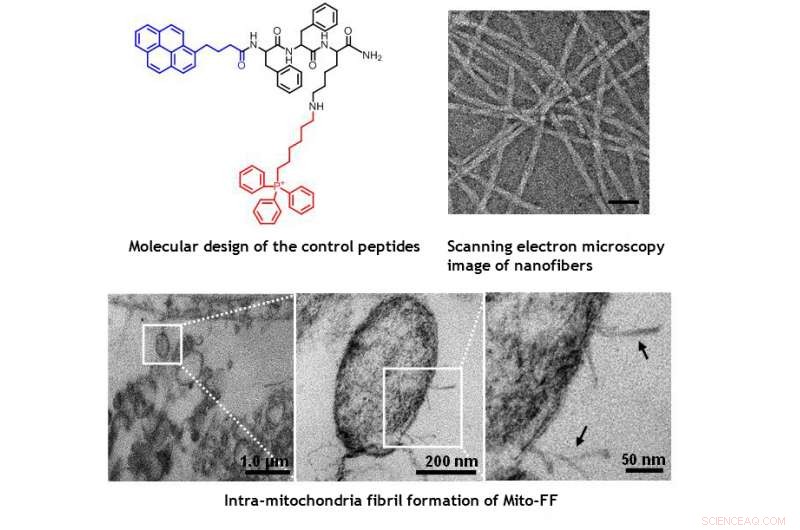
TEM-billeder af mitokondrier i HeLa-cellen, der viser den morfologiske skade forårsaget af Mito-FF. Kredit:UNIST
Intracellulær selvsamling, dermed, kræver en højere koncentration af molekylerne end CAC, hvilket kan begrænse de praktiske implementeringer af selvsamlende molekyler. Transformation af molekylstrukturen fra hydrofile til hydrofobe enheder inde i cellen (eller pericellulært rum) gennem eksterne stimuli (kemisk, eller fysisk) er en stærk strategi til at reducere CAC ved at øge tilbøjeligheden til selvmontering. Imidlertid, kemiske og fysiske stimuli (f.eks. lys, temperatur, pH, og redox) er ikke relevante for intracellulær samling, fordi de forårsager alvorlig skade på cellen.
Professor Ryus forskergruppe introducerede et specifikt cellulært organel-lokaliseringsinduceret supramolekylært selvsamlingssystem (OLISA) kunne være en generel strategi for at fremkalde selvsamling ved at øge lokale koncentrationer af de selvsamlende molekyler uden yderligere behandling. De små molekyler diffunderer let gennem cellemembranen, nå til målstedet (organel eller subcellulært rum afhængigt af målgruppen), og derefter undergår de selvmontering inde i den målrettede organel som følge af øget lokal koncentration. Akkumuleringen af molekyler inde i en organel som mitokondrier er ~ 500-1, 000 gange højere end ekstracellulært rum.
"OLISA er en mere generel og direkte strategi til opnåelse af intracellulær samling og er helt ny, det er en lovende tilgang til at kontrollere den cellulære skæbne som apoptose, celleproliferation osv. og er en nyttig strategi for deres dybtgående undersøgelser, siger professor Ryu.
Designet består af mitokondrier-akkumulerende amfifilt peptid (Mito-FF), som består af diphenylalanin som en β-arkdannende byggesten, TPP som en mitokondriel målrettet gruppe, og pyren som en fluorescerende probe. Mito-FF akkumuleres gunstigt i mitokondrier af kræftceller på grund af det høje negative membranpotentiale og den øgede koncentration fik Mito-FF til at samle sig til en fibrøs struktur, der henviser til, at mangel på fibrildannelse blev observeret i normale celler. De stive Mito-FF-fibriller ødelagde mitokondriemembranen og aktiverede den iboende apoptotiske vej mod kræftceller. Dette OLISA -system tilbyder en ny tilgang til målrettet kræftkemoterapi.
M.T. Jeena of Chemistry hos UNIST, hovedforfatteren af undersøgelsen forventer, at den nye metode danner grundlaget for en ny serie behandlinger, der kan maksimere helingsprocessen og minimere bivirkninger.
 Varme artikler
Varme artikler
-
 Søgemaskine til smart træEnzymet laccase er i stand til at ændre træets kemiske struktur på dets overflade og dermed lette biokemiske ændringer uden at ændre materialets struktur. Imidlertid, der er forskellige lakser - og de
Søgemaskine til smart træEnzymet laccase er i stand til at ændre træets kemiske struktur på dets overflade og dermed lette biokemiske ændringer uden at ændre materialets struktur. Imidlertid, der er forskellige lakser - og de -
 Forskere udvikler molekylær fiskeri for at finde individuelle molekyler i blodDenne figur illustrerer en protein-nanopore-baseret sensor til påvisning af proteiner i en kompleks biologisk væske ved enkeltmolekylær præcision. På venstre side, sensoren, som er et konstrueret tran
Forskere udvikler molekylær fiskeri for at finde individuelle molekyler i blodDenne figur illustrerer en protein-nanopore-baseret sensor til påvisning af proteiner i en kompleks biologisk væske ved enkeltmolekylær præcision. På venstre side, sensoren, som er et konstrueret tran -
 Undersøgelse finder fluor som mulig erstatning for lithium i genopladelige batterierHer, lagdelte elektroder, såsom Ca2N og Y2C - der har en elektron, der optager et gittersted - forudsiges som lovende værter for fluorid-interkalation, fordi deres anioniske elektroner skaber store me
Undersøgelse finder fluor som mulig erstatning for lithium i genopladelige batterierHer, lagdelte elektroder, såsom Ca2N og Y2C - der har en elektron, der optager et gittersted - forudsiges som lovende værter for fluorid-interkalation, fordi deres anioniske elektroner skaber store me -
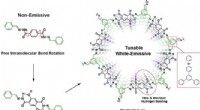 Justerbar emissiv organisk platformFigur viser designprincipperne for udvikling af en justerbar 2D COF, der er i stand til at udsende hvidt lys. Den frie intramolekylære bindingsrotation gør den grundlæggende molekylære enhed ikke-emit
Justerbar emissiv organisk platformFigur viser designprincipperne for udvikling af en justerbar 2D COF, der er i stand til at udsende hvidt lys. Den frie intramolekylære bindingsrotation gør den grundlæggende molekylære enhed ikke-emit
- Sådan konverteres damptryk til koncentration
- Ny kvantehukommelse gemmer information i timevis
- Hvordan reproducerer et Tyrkiet?
- Er en basisindkomst løsningen på vedvarende uligheder, som kvinder står over for?
- I den seneste generation af små biosensorer, størrelse er ikke alt
- Bioengineer har til formål at forvandle naturens virusbekæmpere til kraftfulde stoffer


