Hvad er de typiske egenskaber ved ionisk forbindelse?
Fysiske egenskaber:
* høje smelte- og kogepunkter: Ioniske bindinger er stærke elektrostatiske attraktioner mellem modsat ladede ioner, hvilket kræver en betydelig mængde energi at bryde. Dette fører til høje smelte- og kogepunkter.
* fast ved stuetemperatur: De stærke kræfter, der holder ioner sammen i en stiv gitterstruktur, resulterer normalt i en fast tilstand ved stuetemperatur.
* sprød: Den stive struktur af ioniske forbindelser gør dem tilbøjelige til at knuse, når de rames. Når en ekstern kraft påføres, kan ionerne skifte, hvilket fører til en forkert justering af afgifter og en stærk frastødende kraft, der får krystallen til at bryde.
* gode ledere af elektricitet, når de er smeltet eller opløst: I fast tilstand er ioner fastgjort i deres gitterpositioner og kan ikke bevæge sig frit for at udføre elektricitet. Men når de er smeltet eller opløst, bliver ionerne mobile og kan udføre elektricitet.
* normalt opløselig i polære opløsningsmidler: Vand er et godt opløsningsmiddel for ioniske forbindelser, fordi dets polære molekyler kan omringe og interagere med ionerne, svække de ioniske bindinger og lade forbindelsen opløses.
Kemiske egenskaber:
* reagerer med andre ioniske forbindelser for at danne nye forbindelser: Ioniske reaktioner involverer ofte udveksling af ioner mellem reaktanter. For eksempel reagerer natriumchlorid (NaCl) med sølvnitrat (Agno₃) for at danne sølvchlorid (AgCl) og natriumnitrat (nano₃).
* Formelektrolytter, når de opløses i vand: Når ioniske forbindelser opløses i vand, adskiller de sig i deres bestanddele, som derefter kan udføre elektricitet, hvilket gør opløsningen til en elektrolyt.
Yderligere noter:
* Nogle ioniske forbindelser, som kviksølv (II) -chlorid (HGCL₂), har relativt lave smeltepunkter på grund af svagere ioniske bindinger.
* Egenskaberne ved ioniske forbindelser kan påvirkes af faktorer, såsom størrelse og ladning af ionerne, krystalstrukturen og tilstedeværelsen af urenheder.
Generelt tilskrives de karakteristiske egenskaber ved ioniske forbindelser stort set de stærke elektrostatiske interaktioner mellem modsat ladede ioner og de stive, krystallinske strukturer, de danner.
 Varme artikler
Varme artikler
-
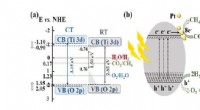 Ny fotokatalysator fremskynder omdannelsen af kuldioxid til kemiske ressourcerEt skematisk diagram, der viser mekanismen for omdannelsen af kuldioxid til metan ved hjælp af det reducerede titaniumdioxid udviklet af holdet. Kredit:DGIST Kuldioxid er en væsentlig årsag til
Ny fotokatalysator fremskynder omdannelsen af kuldioxid til kemiske ressourcerEt skematisk diagram, der viser mekanismen for omdannelsen af kuldioxid til metan ved hjælp af det reducerede titaniumdioxid udviklet af holdet. Kredit:DGIST Kuldioxid er en væsentlig årsag til -
 Nye muligheder for lysemitterende plast med mønstret lysMønstret lys i form af en fisk. Kredit:Mattias Lindh Lysemitterende plast bruges i dag i tv- og smartphone-skærme, lysemitterende indikatorer og som belysning til biler og fly med særlige krav. Vi
Nye muligheder for lysemitterende plast med mønstret lysMønstret lys i form af en fisk. Kredit:Mattias Lindh Lysemitterende plast bruges i dag i tv- og smartphone-skærme, lysemitterende indikatorer og som belysning til biler og fly med særlige krav. Vi -
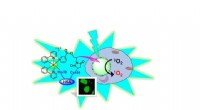 Blot at skinne lys på dinosaurmetalforbindelse dræber kræftcellerIridium med sin organiske pels, som er koblet til proteinet albumin (HSA). Sammen kommer de ind i kræftceller og leverer iridium-fotosensibilisatoren til kernen. Ved bestråling med blåt lys, iridium l
Blot at skinne lys på dinosaurmetalforbindelse dræber kræftcellerIridium med sin organiske pels, som er koblet til proteinet albumin (HSA). Sammen kommer de ind i kræftceller og leverer iridium-fotosensibilisatoren til kernen. Ved bestråling med blåt lys, iridium l -
 Inspireret af naturlige signaler i levende celler, forskere designer kunstig gasdetektorKemikere fra University of Tokyo har designet bittesmå nanokuber, der naturligt lyser blåt under UV-lys. Gløden er 3,9 gange stærkere, når kuberne er fyldt med brændbar gas. Nanokuberne er et første s
Inspireret af naturlige signaler i levende celler, forskere designer kunstig gasdetektorKemikere fra University of Tokyo har designet bittesmå nanokuber, der naturligt lyser blåt under UV-lys. Gløden er 3,9 gange stærkere, når kuberne er fyldt med brændbar gas. Nanokuberne er et første s
- Hvad er målingen, der kombinerer både hastighed og retning af et bevægende objekt kaldet?
- Tværfaglig tilgang gør det muligt at forbinde biologiske materialer og elektroniske enheder
- Forskere skaber en kemisk rumkortlægningsmetode og knækker mysteriet om Mendeleev-nummeret
- Er en elektrisk strøm en bevægelse af elektroner i nærheden af hastighedslyset?
- Hvilket energisystem bruger Javelin?
- Hvad er den tykeste del af tektoniske plader?


