Hvorfor er rent vandneutral på trods af, at produktionen af hydrogenioner og hydroxidioner?
`` `
2 H₂O ⇌ H₃O + + OH-
`` `
Dobbeltpilen angiver, at reaktionen er reversibel , hvilket betyder, at det går i begge retninger. Ved ligevægt er hastigheden for den fremadgående reaktion (dannelse af H₃O+ og OH-) lig med hastigheden for den omvendte reaktion (dannelse af to vandmolekyler).
Så hvorfor er ren vandneutral? Det er fordi -koncentrationerne af H+ og OH-ioner er ens .
I rent vand er koncentrationen af både H+ og OH- er 1 x 10^-7 mol pr. Liter , der svarer til en pH på 7.
Her er hvorfor lige koncentrationer fører til neutralitet:
* ph -skala: PH -skalaen måler surhedsgraden eller alkaliniteten af en opløsning. En pH -værdi på 7 betragtes som neutral, under 7 er surt, og over 7 er alkalisk (grundlæggende).
* H+ og OH- Balance: Aciditet bestemmes af koncentrationen af H+ -ioner, mens alkalinitet bestemmes af koncentrationen af OH-ioner.
* neutralisering: Når koncentrationerne af H+ og OH- er lige, neutraliserer de effektivt hinanden, hvilket resulterer i en neutral pH.
Kortfattet:
Mens rent vand gennemgår autoionisering, fører de lige store koncentrationer af H+ og OH-ioner produceret til en neutral pH. Det er en balance mellem dannelsen og rekombinationen af disse ioner, der holder rent vandneutral.
 Varme artikler
Varme artikler
-
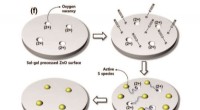 Realisering af farvefilterfri billedsensorerSkematisk mekanisme for S-doping af sol-gel-behandlet ZnO-film. Spin-coated thiocyanation (SCN?) omdannes til aktive S arter ved varmebehandling og migreres til ilt ledige steder ved elektrostatisk kr
Realisering af farvefilterfri billedsensorerSkematisk mekanisme for S-doping af sol-gel-behandlet ZnO-film. Spin-coated thiocyanation (SCN?) omdannes til aktive S arter ved varmebehandling og migreres til ilt ledige steder ved elektrostatisk kr -
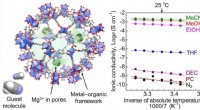 Ny superionisk magnesiumleder til lithium-fri solid-state batterierDen nye Mg2+ lederen består af en metal-organisk ramme, der holder Mg2+ ioner i sine porer. Et gæstemolekyle acetonitril indføres i strukturen for at accelerere den ioniske ledningsevne af Mg2+ og til
Ny superionisk magnesiumleder til lithium-fri solid-state batterierDen nye Mg2+ lederen består af en metal-organisk ramme, der holder Mg2+ ioner i sine porer. Et gæstemolekyle acetonitril indføres i strukturen for at accelerere den ioniske ledningsevne af Mg2+ og til -
 Ny højhastighedstest viser, hvordan antibiotika kombineres for at dræbe bakterierMed den modificerede agarplade CombiANT er det muligt at lave højhastighedstests for at se, hvordan bakterier reagerer på forskellige kombinationer af antibiotika. Kredit:Nikos Fatsis-Kavalopoulos
Ny højhastighedstest viser, hvordan antibiotika kombineres for at dræbe bakterierMed den modificerede agarplade CombiANT er det muligt at lave højhastighedstests for at se, hvordan bakterier reagerer på forskellige kombinationer af antibiotika. Kredit:Nikos Fatsis-Kavalopoulos -
 Forskere udvikler molekylært termometer til kontaktløs måling ved hjælp af infrarødt lysDen molekylære rubin i fast (rød) og opløst (gul) tilstand kan bruges til kontaktløs måling af temperatur. Kredit:Sven Otto, JGU Kemikere ved Johannes Gutenberg University Mainz (JGU) har i samarb
Forskere udvikler molekylært termometer til kontaktløs måling ved hjælp af infrarødt lysDen molekylære rubin i fast (rød) og opløst (gul) tilstand kan bruges til kontaktløs måling af temperatur. Kredit:Sven Otto, JGU Kemikere ved Johannes Gutenberg University Mainz (JGU) har i samarb
- Hvor er havisen? 3 grunde til, at Arctic freeze er uhyggeligt sent, og hvorfor det betyder noget
- Hvordan skriver du 2,1 tusind i videnskabelig notation?
- Hvad er to hovedformer for energi, der er afgivet, når papir brænder?
- Hvordan er vejret på Mercury?
- Ny type lavenergi nanolaser, der skinner i alle retninger
- Undersøgte beviser for ansættelsesdiskrimination mod ikke-hvide grupper i ni lande


