Hvordan finder du molær ledningsevne af NaCI ved uendelig fortynding, når man får konduktiviteter licl nano3 og lino3?
Her er hvordan:
Kohlrauschs lov siger, at den molære ledningsevne af en stærk elektrolyt ved uendelig fortynding er summen af de begrænsende ioniske ledningsevne af dens bestanddele.
trin:
1. Identificer de begrænsende ioniske ledninger:
* Lad λ ° li+ Repræsenterer den begrænsende molære ledningsevne af lithiumionen (Li + ).
* Lad λ ° cl- Repræsenterer den begrænsende molære ledningsevne af chloridionen (cl - ).
* Lad λ ° Na+ Repræsenterer den begrænsende molære ledningsevne af natriumionen (NA + ).
* Lad λ ° NO3- Repræsenterer den begrænsende molære ledningsevne af nitrationen (ingen 3 - ).
2. Skriv ligningerne for de givne ledningsevne:
* Λ ° licl =Λ ° li+ + Λ ° Cl-
* Λ ° nano3 =Λ ° Na+ + Λ ° NO3-
* Λ ° lino3 =Λ ° li+ + Λ ° NO3-
3. ):
* Λ ° naCl =Λ ° Na+ + Λ ° Cl-
4. Kombiner ligningerne for at eliminere uønskede udtryk:
* Træk ligningen for λ ° lino3 Fra ligningen for λ ° nano3 at få:
Λ ° nano3 - λ ° lino3 =Λ ° Na+ - λ ° li+
* Tilføj dette resultat til ligningen for λ ° licl :
(Λ ° nano3 - λ ° lino3 ) + Λ ° licl =Λ ° Na+ - λ ° li+ + Λ ° li+ + Λ ° Cl-
* Forenkle:λ ° NaCl =Λ ° nano3 - λ ° lino3 + Λ ° licl
Derfor er den molære ledningsevne af NaCI ved uendelig fortynding (λ ° NaCl ) er lig med summen af de molære ledningsevner af Nano 3 og licl minus den molære ledningsevne af lino 3 .
Vigtig note: Denne metode er afhængig af antagelsen om, at alle elektrolytter er stærke elektrolytter, hvilket betyder, at de fuldt ud adskiller sig i ioner i opløsning.
Sidste artikelHvad er formlen for jern II -sulfid?
Næste artikelNår et kloratom får et elektron, hvad er det opladet?
 Varme artikler
Varme artikler
-
 En selvhelende kompositKredit:Ecole Polytechnique Federale de Lausanne Forskere fra EPFLs laboratorium til behandling af avancerede kompositter har udviklet et materiale, der let kan helbrede efter at være blevet beskad
En selvhelende kompositKredit:Ecole Polytechnique Federale de Lausanne Forskere fra EPFLs laboratorium til behandling af avancerede kompositter har udviklet et materiale, der let kan helbrede efter at være blevet beskad -
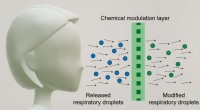 Ansigtsmaske har til formål at deaktivere virus for at beskytte andreSkematisk viser, hvordan et kemisk modulationslag sanerer ansigtsmaskebærerens luftvejsdråber. Kredit:Northwestern University I pandemien, folk bærer ansigtsmasker for at respektere og beskytte an
Ansigtsmaske har til formål at deaktivere virus for at beskytte andreSkematisk viser, hvordan et kemisk modulationslag sanerer ansigtsmaskebærerens luftvejsdråber. Kredit:Northwestern University I pandemien, folk bærer ansigtsmasker for at respektere og beskytte an -
 Marangoni-effekten kan bruges til at få ferskvand fra havetKredit:CC0 Public Domain En undersøgelse udført på Politecnico di Torino, i samarbejde med Massachusetts Institute of Technology (MIT), og publiceret i tidsskriftet Energi- og miljøvidenskab , p
Marangoni-effekten kan bruges til at få ferskvand fra havetKredit:CC0 Public Domain En undersøgelse udført på Politecnico di Torino, i samarbejde med Massachusetts Institute of Technology (MIT), og publiceret i tidsskriftet Energi- og miljøvidenskab , p -
 Teamet skaber den første VX-neurotoksindetektor nogensindeEt VX-detekterende protein designet af Koder Lab på CCNY. Kredit:Koder Lab/CCNY City College of New York lektor i fysik Ronald Koder og hans team ved Koder Lab fremmer området for molekylær detekti
Teamet skaber den første VX-neurotoksindetektor nogensindeEt VX-detekterende protein designet af Koder Lab på CCNY. Kredit:Koder Lab/CCNY City College of New York lektor i fysik Ronald Koder og hans team ved Koder Lab fremmer området for molekylær detekti


