Hvorfor bliver et natriumatom mere stabilt, når det mister en valenselektron?
* octet regel: Atomer stræber efter at opnå en stabil elektronkonfiguration og ligner de ædle gasser. Ædle gasser har en fuld ydre skal af elektroner, hvilket gør dem meget ureaktive. Octet -reglen siger, at atomer har en tendens til at vinde, miste eller dele elektroner for at have otte elektroner i deres yderste skal.
* natriums elektronkonfiguration: Natrium (NA) har 11 elektroner. Dens elektronkonfiguration er 2, 8, 1. Dette betyder, at den har en elektron i sin yderste skal (Valence Shell).
* mister en elektron: Ved at miste sin enkelt valenselektron bliver natrium en positivt ladet ion (Na+). Dens nye elektronkonfiguration er 2, 8, der matcher den stabile elektronkonfiguration af Neon (NE), en ædel gas.
* stabilitet gennem fyldte skaller: At have en fuld ydre skal gør natrium mere stabil, fordi:
* Det eliminerer tendensen til at reagere med andre atomer for at vinde eller dele elektroner for at opnå en fuld ydre skal.
* Den elektrostatiske tiltrækning mellem kernen og de resterende elektroner er stærkere, hvilket gør ionen mere stabil.
Kortfattet: Natrium mister sin valenselektron for at opnå en stabil oktetkonfiguration som neon, hvilket gør den mere stabil og mindre reaktiv.
Sidste artikelHvad giver natrium plus brint?
Næste artikelHvorfor påvirker NaCl og KCL ikke hårdhed i vand?
 Varme artikler
Varme artikler
-
 Brændstof og kemikalier fra planteaffaldPSI-forsker Patrick Hemberger ved VUV-strålelinjen af den schweiziske lyskilde SLS. Her undersøgte han og kolleger detaljerne omkring nedbrydningen af lignin til andre stoffer. Resultaterne kan bi
Brændstof og kemikalier fra planteaffaldPSI-forsker Patrick Hemberger ved VUV-strålelinjen af den schweiziske lyskilde SLS. Her undersøgte han og kolleger detaljerne omkring nedbrydningen af lignin til andre stoffer. Resultaterne kan bi -
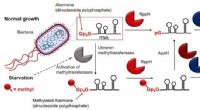 Opdagelse af helt ny klasse af RNA -hætter i bakterierGrafisk abstrakt. Kredit:Hudeček, O., Benoni, R., Reyes-Gutierrez, P.E. et al. Gruppen af Dr. Hana Cahová fra CAS, Institute of Organic Chemistry and Biochemistry, i samarbejde med forskere fra
Opdagelse af helt ny klasse af RNA -hætter i bakterierGrafisk abstrakt. Kredit:Hudeček, O., Benoni, R., Reyes-Gutierrez, P.E. et al. Gruppen af Dr. Hana Cahová fra CAS, Institute of Organic Chemistry and Biochemistry, i samarbejde med forskere fra -
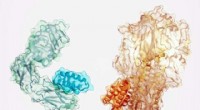 Ny metode til at generere potente, specifikke bindingsproteiner til nye lægemidlerSmå proteiner (mørkere nuance) designet til at binde sig til insulinreceptoren (venstre) og en komponent af influenzavirussen (højre). Kredit:Ian C. Haydon/Institute for Protein Design Et team af v
Ny metode til at generere potente, specifikke bindingsproteiner til nye lægemidlerSmå proteiner (mørkere nuance) designet til at binde sig til insulinreceptoren (venstre) og en komponent af influenzavirussen (højre). Kredit:Ian C. Haydon/Institute for Protein Design Et team af v -
 Oplader ind i fremtiden – nyt stensalt til brug i genopladelige magnesiumbatterierEn unik metode til at bruge nyt stensalt i genopladelige magnesiumbatterier. Kredit:Tokyo University of Science Livet i dag afhænger i høj grad af elektricitet. Imidlertid, den utrættelige eftersp
Oplader ind i fremtiden – nyt stensalt til brug i genopladelige magnesiumbatterierEn unik metode til at bruge nyt stensalt i genopladelige magnesiumbatterier. Kredit:Tokyo University of Science Livet i dag afhænger i høj grad af elektricitet. Imidlertid, den utrættelige eftersp


