Hvad er den elektroniske struktur af et kloratom 2 8 7?
* 2, 8, 7 Repræsenterer antallet af elektroner i hvert af chloratomets elektronskaller.
* Shell 1: Indeholder 2 elektroner (repræsenteret af '2').
* Shell 2: Indeholder 8 elektroner (repræsenteret af '8').
* Shell 3: Indeholder 7 elektroner (repræsenteret af '7').
Her er en mere detaljeret sammenbrud:
* 1S²: Dette betyder, at der er 2 elektroner i det første energiniveau (shell 1), der også kaldes "S" -subskalet.
* 2s² 2p⁶: Dette betyder, at der er 8 elektroner i det andet energiniveau (shell 2) med 2 elektroner i "S" underskalet og 6 i "P" underskalet.
* 3s² 3p⁵: Dette betyder, at der er 7 elektroner i det tredje energiniveau (shell 3) med 2 elektroner i "S" -underskallen og 5 i "P" underskalet.
Vigtig note: Den elektroniske konfiguration hjælper os med at forstå klorens kemiske opførsel. Det har 7 elektroner i sin yderste skal (valenselektroner), hvilket gør det meget reaktivt og sandsynligvis får et elektron for at opnå en stabil oktet i sin ydre skal. Denne tendens er grunden til, at klor er et stærkt oxidationsmiddel.
Sidste artikelHvor mange valanceelektroner i ilt?
Næste artikelHvad er balance ligningen til tilsætning af natriumbisulfat til acetone?
 Varme artikler
Varme artikler
-
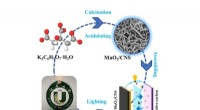 Carbon nanoark som en kompetent assistent til mangandioxid viser bemærkelsesværdig ydeevne i super…Kredit:Higher Education Press I forbindelse med kulstofneutralitet har superkondensatorer, som en ny grøn energilagringsenhed, vist fordele såsom hurtig opladning og afladning, høj effekttæthed og
Carbon nanoark som en kompetent assistent til mangandioxid viser bemærkelsesværdig ydeevne i super…Kredit:Higher Education Press I forbindelse med kulstofneutralitet har superkondensatorer, som en ny grøn energilagringsenhed, vist fordele såsom hurtig opladning og afladning, høj effekttæthed og -
 Undersøgelse giver ny indsigt i stålfremstilling af røggasbehandlingScanning af elektronmikroskopbilleder af den friske Cu2 O (A) og brugt katalysator til CC (B) og CLC (C) processer. Kredit:IMCAS Både katalytisk forbrænding (CC) og Chemical looping combustion (CLC
Undersøgelse giver ny indsigt i stålfremstilling af røggasbehandlingScanning af elektronmikroskopbilleder af den friske Cu2 O (A) og brugt katalysator til CC (B) og CLC (C) processer. Kredit:IMCAS Både katalytisk forbrænding (CC) og Chemical looping combustion (CLC -
 Forskere opdager ny elektrokatalysator til at omdanne kuldioxid til flydende brændstofKunstnerisk gengivelse af elektrokatalytisk proces til omdannelse af kuldioxid og vand til ethanol. Kredit:Kredit:Argonne National Laboratory Katalysatorer fremskynder kemiske reaktioner og danner
Forskere opdager ny elektrokatalysator til at omdanne kuldioxid til flydende brændstofKunstnerisk gengivelse af elektrokatalytisk proces til omdannelse af kuldioxid og vand til ethanol. Kredit:Kredit:Argonne National Laboratory Katalysatorer fremskynder kemiske reaktioner og danner -
 Heliumioner åbner en helt ny verden af materialerKredit:Queensland University of Technology QUT-forskere har fundet en spændende ny måde at manipulere og designe fremtidens materialer på atomniveau og ændre den måde, de opfører sig på i større s
Heliumioner åbner en helt ny verden af materialerKredit:Queensland University of Technology QUT-forskere har fundet en spændende ny måde at manipulere og designe fremtidens materialer på atomniveau og ændre den måde, de opfører sig på i større s
- Hvad er formlen for svovl og brom?
- Hvorfor har celler brug for mad?
- Hvem opfandt Celestial Navigation?
- Glasovergang møder Fickian-non-Gaussian Diffusion
- Som en prøve af radioaktivt grundstof henfalder dens halveringstid?
- Undersøgelse af den økonomiske virkning af grænsemuren finder høje omkostninger og få fordele f…


