Hvordan kan den kemiske aktivitet af et element bestemmes ud fra dets placering i periodisk tabel?
1. Gruppe (kolonne):
* alkalimetaller (gruppe 1): Meget reaktivt, mister let en elektron til dannelse af +1 kationer. Deres reaktivitet øges ned i gruppen.
* alkaliske jordmetaller (gruppe 2): Reaktive mister let to elektroner til dannelse af +2 kationer. Reaktivitet øges ned i gruppen.
* halogener (gruppe 17): Meget reaktive ikke -metaller, får let en elektron til dannelse af -1 anioner. Reaktivitet falder ned i gruppen.
* ædle gasser (gruppe 18): Inerte, meget stabile på grund af deres fulde ydre elektronskaller. De danner sjældent forbindelser.
2. Periode (række):
* Elektronegativitet: Et atomens tendens til at tiltrække elektroner i en binding øges over en periode (fra venstre mod højre), når antallet af protoner i kernen øges, hvilket fører til stærkere tiltrækning for elektroner.
* ioniseringsenergi: Den energi, der kræves for at fjerne et elektron fra et atom, øges på tværs af en periode på grund af den stærkere attraktion mellem kernen og elektronerne.
* Metallisk karakter: Elementer på venstre side af en periode er mere metalliske, mens elementer på højre side er mere ikke -metalliske. Denne tendens er relateret til elektronegativitet og ioniseringsenergi.
3. Andre faktorer:
* Elektronkonfiguration: Arrangementet af elektroner i den yderste skal (valenselektroner) påvirker direkte kemisk reaktivitet. Elementer med en fuld ydre skal er meget stabile (ædelgasser), mens elementer med delvist fyldte skaller er mere reaktive.
* atomstørrelse: Atomstørrelse falder på tværs af en periode og øges ned ad en gruppe. Mindre atomer har en større tiltrækning for elektroner, hvilket fører til højere reaktivitet.
* afskærmning: Indre elektroner beskytter de ydre elektroner mod atomladningen. Elementer med flere indre elektroner oplever mindre tiltrækning fra kernen, hvilket resulterer i lavere ioniseringsenergi og højere reaktivitet.
Eksempel:
* natrium (NA) er i gruppe 1, hvilket betyder, at det er et alkalimetal. Det har en valenselektron og mister let den til at danne en +1 -kation, hvilket gør den meget reaktiv.
* klor (Cl) er i gruppe 17, hvilket betyder, at det er et halogen. Det har syv valenselektroner og får let en elektron til dannelse af en -1 -anion, hvilket gør det meget reaktivt.
Husk:
* Dette er generelle tendenser, og der er altid undtagelser.
* Den periodiske tabel giver en værdifuld ramme for forståelse af kemisk reaktivitet, men det er ikke en perfekt prediktor.
Ved at forstå disse tendenser og faktorer kan du foretage informerede forudsigelser om den kemiske aktivitet af elementer baseret på deres placering i den periodiske tabel.
Sidste artikelHvad er et eksempel på oxidmineral?
Næste artikelHvor mange valanceelektroner i ilt?
 Varme artikler
Varme artikler
-
 Team udvikler separator, der reducerer gasovergang til vandelektrolysatorSammenligning af porestørrelsesfordeling af separationsmembran:KIER separationsmembran (Z75 ~ Z85), Kommerciel membran (Zirfon). Kredit:Korea Institute of Energy Research (KIER) Dr. Won-chul Cho f
Team udvikler separator, der reducerer gasovergang til vandelektrolysatorSammenligning af porestørrelsesfordeling af separationsmembran:KIER separationsmembran (Z75 ~ Z85), Kommerciel membran (Zirfon). Kredit:Korea Institute of Energy Research (KIER) Dr. Won-chul Cho f -
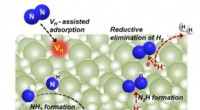 Overgangsmetalfrit bariumhydrid medierer dinitrogenfiksering og ammoniaksynteseOvergangsmetalfri dinitrogenfiksering medieret af bariumhydrid. Kredit:Guan Yeqin Ammoniak er afgørende for fremstillingen af kvælstofgødning. På grund af det høje energiforbrug ved industriel am
Overgangsmetalfrit bariumhydrid medierer dinitrogenfiksering og ammoniaksynteseOvergangsmetalfri dinitrogenfiksering medieret af bariumhydrid. Kredit:Guan Yeqin Ammoniak er afgørende for fremstillingen af kvælstofgødning. På grund af det høje energiforbrug ved industriel am -
 Quantum dot solcelleanlæg gør et varigt indtrykEn blysulfid-kvanteprik med langkædede overfladeligander. Solceller lavet med kvanteprikker viser stort løfte som næste generation af solcelleteknologi, men har brug for at demonstrere langsigtet stab
Quantum dot solcelleanlæg gør et varigt indtrykEn blysulfid-kvanteprik med langkædede overfladeligander. Solceller lavet med kvanteprikker viser stort løfte som næste generation af solcelleteknologi, men har brug for at demonstrere langsigtet stab -
 Squishy hydras simple kredsløb klar til deres nærbilledeEn hydra trækkes ind i en pipette som forberedelse til indsættelse i et mikrofluidisk kammer. Kredit:Jeff Fitlow Bare fordi et dyr er blødt og squishy, betyder det ikke, at det ikke er hårdt. Ek
Squishy hydras simple kredsløb klar til deres nærbilledeEn hydra trækkes ind i en pipette som forberedelse til indsættelse i et mikrofluidisk kammer. Kredit:Jeff Fitlow Bare fordi et dyr er blødt og squishy, betyder det ikke, at det ikke er hårdt. Ek
- SpaceX lancerer AI-robot, stærk kaffe til stationsbesætning
- Identificer to måder, som organismer kan sammenlignes for at give bevis for evolution fra en fælle…
- Samarbejde fører til øget tillid til landbrugets naturforvaltning
- Hvor meget er 1,25 tommer til centimeter?
- Klimapanel opløst af Trump, nu omgrupperet, udgiver sin rapport
- Syntese af et sjældent metalkompleks af dinitrogenoxid åbner nye udsigter for


