Er et svovlatom større end et fosfor atom?
Her er hvorfor:
* atomradius: Atomradius øges generelt, når du bevæger dig ned ad en gruppe på den periodiske tabel og falder, når du bevæger dig over en periode fra venstre mod højre.
* placering på periodisk tabel: Svovl (er) og fosfor (P) er begge i den tredje periode af den periodiske tabel. Svovl er placeret i gruppe 16, mens fosfor er placeret i gruppe 15.
* Elektronafskærmning: Når du bevæger dig fra venstre mod højre over en periode, øges antallet af protoner i kernen, hvilket tiltrækker elektronerne stærkere. Dette gør atomradiusen mindre.
Derfor har fosfor, der er længere til venstre på den periodiske tabel, en større atomradius end svovl.
 Varme artikler
Varme artikler
-
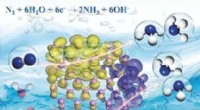 Ammoniaksyntese gennem elektroreduktion af nitrogen på sorte fosfor nanosheetsKredit:Wiley Mere end 100 år efter introduktionen af Haber -Bosch -processen, forskere fortsætter med at søge efter alternative ammoniakproduktionsruter, der er mindre energikrævende. Kinesiske
Ammoniaksyntese gennem elektroreduktion af nitrogen på sorte fosfor nanosheetsKredit:Wiley Mere end 100 år efter introduktionen af Haber -Bosch -processen, forskere fortsætter med at søge efter alternative ammoniakproduktionsruter, der er mindre energikrævende. Kinesiske -
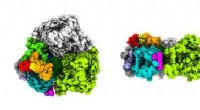 Unikke pigmenter i fotosyntetiske marinebakterier afslører, hvordan den lever i svagt lysFigur 1:Et kryo-elektronmikroskopi tæthedskort over Acaryochloris marina fotosystem I afslører strukturelle elementer, der gør det muligt for det at omdanne lavenergilys til kemisk energi. Kredit:Æn
Unikke pigmenter i fotosyntetiske marinebakterier afslører, hvordan den lever i svagt lysFigur 1:Et kryo-elektronmikroskopi tæthedskort over Acaryochloris marina fotosystem I afslører strukturelle elementer, der gør det muligt for det at omdanne lavenergilys til kemisk energi. Kredit:Æn -
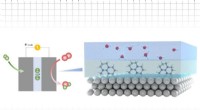 At gøre katalytiske overflader mere aktive for at hjælpe med at dekarbonisere brændstoffer og kem…Kredit:Massachusetts Institute of Technology Elektrokemiske reaktioner, der accelereres ved hjælp af katalysatorer, er kernen i mange processer til fremstilling og brug af brændstoffer, kemikalier
At gøre katalytiske overflader mere aktive for at hjælpe med at dekarbonisere brændstoffer og kem…Kredit:Massachusetts Institute of Technology Elektrokemiske reaktioner, der accelereres ved hjælp af katalysatorer, er kernen i mange processer til fremstilling og brug af brændstoffer, kemikalier -
 En ny måde at fremstille MXene-film på, der blokerer for elektromagnetisk interferensMed boomet i bærbar elektronik, Internet of Things-enheder og mere, belægninger, der blokerer for elektromagnetisk stråling, er ved at blive en kritisk del af fremstillingsprocessen. Andre ́ D. Taylor
En ny måde at fremstille MXene-film på, der blokerer for elektromagnetisk interferensMed boomet i bærbar elektronik, Internet of Things-enheder og mere, belægninger, der blokerer for elektromagnetisk stråling, er ved at blive en kritisk del af fremstillingsprocessen. Andre ́ D. Taylor
- Hvordan ikke-hjemmehørende træarter påvirker biodiversiteten
- Hundredtusinder deltager i børns klimastrejker i Europa
- Største virksomheder betaler mindst skat, efterlader samfundet mere sårbart over for pandemier
- Hvad er forskellen mellem et halvautomatisk våben og et maskingevær?
- "Anti-Cancer Creepy Crawlies?", 3, [[Yup - At spise bugs er fantastisk til You
- Hvordan fysik forklarer naturfænomenet ved hjælp af grundlæggende lov og principper?


