Hvad er tre fakta om en kemisk reaktion leveret af ligning?
1. Identiteterne af reaktanter og produkter: Den kemiske ligning viser tydeligt de specifikke kemiske formler for de stoffer, der er involveret i reaktionen. Dette fortæller dig nøjagtigt, hvilke molekyler der reagerer (reaktanter), og hvilke molekyler der dannes (produkter). For eksempel i ligningen:
* 2 H₂ + O₂ → 2 H₂O
* Vi ved, at brint (H₂) og ilt (O₂) er reaktanterne, og vand (H₂O) er produktet.
2. de relative mængder reaktanter og produkter: Koefficienterne foran hver kemisk formel repræsenterer støkiometrien af reaktionen. De fortæller dig det relative antal mol (eller molekyler) af hvert involveret stof. For eksempel i ligningen ovenfor:
* 2 H₂ + O₂ → 2 H₂O
* Koefficienterne indikerer, at to mol brint reagerer med en mol ilt for at producere to mol vand. Disse oplysninger er afgørende for at forstå reaktionens effektivitet og til beregning af teoretiske udbytter.
3. reaktionstypen: Selvom ikke altid eksplicit angivet, kan ligningen undertiden give ledetråde om den type reaktion, der forekommer. For eksempel:
* forbrænding: Involverer ofte ilt som reaktant og produktion af kuldioxid og vand.
* syre-base-reaktion: Vil normalt vise en syre, der reagerer med en base, hvilket resulterer i dannelse af salt og vand.
* Nedbrydning: En reaktant bryder ned i flere produkter.
Det er vigtigt at huske, at den kemiske ligning kun giver oplysninger om stofferne og deres relative beløb *i den afbalancerede tilstand *. Det fortæller dig ikke om reaktionshastigheden, reaktionsmekanismen eller de betingelser, der er nødvendige for, at reaktionen kan forekomme.
 Varme artikler
Varme artikler
-
 Skræddersyet kunstig perlemorEt tværsnit af en perlemor-imitation viser, at ved temperaturer på 800 grader Celsius og derover, der dannes knopper mellem blodpladerne, som størkner materialet. Kredit:Kunal Masania / ETH Zürich
Skræddersyet kunstig perlemorEt tværsnit af en perlemor-imitation viser, at ved temperaturer på 800 grader Celsius og derover, der dannes knopper mellem blodpladerne, som størkner materialet. Kredit:Kunal Masania / ETH Zürich -
 Ny NIST-forskning kan nedbringe omkostningerne ved at lave nikkelNår du designer en ny mønt, Amerikanske regeringsorganer som NIST bruger et dummy-aftryk for ikke at løbe på kant med reglerne mod varemærkeforfalskning. Her, Martha Washington i en pøbelkasket træder
Ny NIST-forskning kan nedbringe omkostningerne ved at lave nikkelNår du designer en ny mønt, Amerikanske regeringsorganer som NIST bruger et dummy-aftryk for ikke at løbe på kant med reglerne mod varemærkeforfalskning. Her, Martha Washington i en pøbelkasket træder -
 Metalliske nanokatalysatorer imiterer strukturen af enzymerKredit:RUB, Marquard Et internationalt hold af forskere har overført visse strukturelle egenskaber ved naturlige enzymer, som sikrer særlig høj katalytisk aktivitet, til metalliske nanopartikler.
Metalliske nanokatalysatorer imiterer strukturen af enzymerKredit:RUB, Marquard Et internationalt hold af forskere har overført visse strukturelle egenskaber ved naturlige enzymer, som sikrer særlig høj katalytisk aktivitet, til metalliske nanopartikler. -
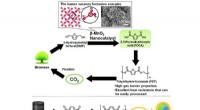 Grønne katalysatorer med jordrige metaller fremskynder produktionen af biobaseret plastUdskiftning af fossilbaseret PET, kendt som råmateriale til sodavandsflasker, med biobaseret PEF bidrager i høj grad til reduktion af CO 2 emissioner. Kredit:Keigo Kamata fra Tokyo Institute of Tech
Grønne katalysatorer med jordrige metaller fremskynder produktionen af biobaseret plastUdskiftning af fossilbaseret PET, kendt som råmateriale til sodavandsflasker, med biobaseret PEF bidrager i høj grad til reduktion af CO 2 emissioner. Kredit:Keigo Kamata fra Tokyo Institute of Tech
- Astronomer bestemmer afstande til 18 dværggalakser
- Hvordan dannes vulkaner i ildringen?
- Hvad er den afbalancerede ligning for Alpha Decay Astatine-217?
- Hvorfor en ekstra helix bliver et tredje hjul i cellebiologi
- Kan der findes ilt i sten?
- Kogevandsmeddelelse løftet fra Texas by, hvor mikroben blev fundet


