Er hydrogenphosphat et polært molekyle?
* asymmetrisk form: Fosfationen (Po₄³⁻) har en tetrahedral form med fire iltatomer, der omgiver phosphoratomet. Tilsætningen af et hydrogenatom til et af iltatomerne introducerer en asymmetri til molekylet.
* Elektronegativitetsforskel: Oxygen er mere elektronegativ end både fosfor og brint. Dette betyder, at iltatomerne trækker elektrondensitet væk fra fosfor- og hydrogenatomer, hvilket skaber delvis negative ladninger på iltatomerne og delvis positive ladninger på fosfor- og hydrogenatomer.
* dipolmoment: Den ujævne fordeling af elektrondensitet resulterer i et netto dipolmoment, hvilket gør molekylet polært.
På grund af dens asymmetriske form og tilstedeværelsen af polære bindinger betragtes hydrogenphosphat derfor som et polært molekyle.
Sidste artikelNår et molekyle har en positiv ende og negativ kaldes den?
Næste artikelHvorfor er ilt ikke et polært molekyle?
 Varme artikler
Varme artikler
-
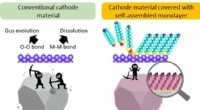 Bygger et bedre batteri, lag for lag(LEFT) Direkte kontakt med elektrolytter forårsager katodeerosion. (HØJRE) Dækkede katodens overflade med selvmonteret enkeltlag, både effekttætheden og cyklabiliteten kan forbedres i højspændings lit
Bygger et bedre batteri, lag for lag(LEFT) Direkte kontakt med elektrolytter forårsager katodeerosion. (HØJRE) Dækkede katodens overflade med selvmonteret enkeltlag, både effekttætheden og cyklabiliteten kan forbedres i højspændings lit -
 Polyamider fra terpener:Amorf Caramid-R og semi-krystallinsk Caramid-SFra træaffald til højtydende polymerer:Terpener fra terpentinolie omdannes til biobaserede, varmestabile polyamider. Kredit:Fraunhofer IGB Fraunhofer Institute for Interfacial Engineering and Biot
Polyamider fra terpener:Amorf Caramid-R og semi-krystallinsk Caramid-SFra træaffald til højtydende polymerer:Terpener fra terpentinolie omdannes til biobaserede, varmestabile polyamider. Kredit:Fraunhofer IGB Fraunhofer Institute for Interfacial Engineering and Biot -
 Hydrogen-drevet mobilitet går tættere på med næste generations brændselscellesystemerKredit:metamorworks, Shutterstock Forskere har gjort betydelige fremskridt i designet af vitale komponenter, der bruges i brintbrændselscellekøretøjer. Forbedrede funktioner vil sænke produktionso
Hydrogen-drevet mobilitet går tættere på med næste generations brændselscellesystemerKredit:metamorworks, Shutterstock Forskere har gjort betydelige fremskridt i designet af vitale komponenter, der bruges i brintbrændselscellekøretøjer. Forbedrede funktioner vil sænke produktionso -
 Hvad hvis vi kunne designe kraftfulde lægemidler uden uønskede bivirkninger?Kredit:CC0 Public Domain Psykedelika såsom LSD og magiske svampe har vist sig meget effektive til behandling af depression og posttraumatiske stresslidelser, men medicinsk brug af disse stoffer er
Hvad hvis vi kunne designe kraftfulde lægemidler uden uønskede bivirkninger?Kredit:CC0 Public Domain Psykedelika såsom LSD og magiske svampe har vist sig meget effektive til behandling af depression og posttraumatiske stresslidelser, men medicinsk brug af disse stoffer er
- Naturbrand truer Spaniens naturpark
- Diskrimination på boligmarkedet hæmmer en vellykket integration
- NASA udvælger 12 nye astronauter fra forelskelsen af ansøgere (Opdatering)
- Forskere finder en skadelig issky på Saturns måne Titan
- For renere luft, vand, og jord
- Hvad er nogle af grundene til, at elektriske isolatorer er vigtige for os?


