Hvad er forskellene mellem molekylære bindinger og ioniske bindinger?
molekylære bindinger (kovalente bindinger)
* dannelse: Atomer deler elektroner for at opnå en stabil elektronkonfiguration (normalt en fuld ydre skal).
* Elektronegativitet: Involverede atomer har lignende elektronegativiteter (tiltrækning for elektroner). Forskellen i elektronegativitet er lille, normalt mindre end 1,7.
* limningstype: Deling af elektroner.
* resulterende forbindelser: Normalt danner molekyler (diskrete enheder), ofte gasser eller væsker ved stuetemperatur.
* egenskaber:
* lavere smeltnings- og kogepunkter: Fordi obligationerne er svagere, er der behov for mindre energi for at bryde dem.
* Typisk ikke-ledende: Elektroner er lokaliseret i molekylet, ikke fri til at bevæge sig.
* kan være polær eller ikke-polær: Afhænger af symmetrien af molekylet og elektronegativitetsforskellen mellem atomerne.
Eksempler:
* Vand (H₂O) - Brint- og iltatomerne deler elektroner.
* Methan (CH₄) - Carbon- og hydrogenatomer deler elektroner.
ioniske bindinger
* dannelse: Et atom (typisk et metal) mister en eller flere elektroner og bliver en positivt ladet ion (kation). Et andet atom (typisk et ikke-metal) får disse elektroner og bliver en negativt ladet ion (anion). Modsatte afgifter tiltrækker og danner obligationen.
* Elektronegativitet: Involverede atomer har signifikant forskellige elektronegativiteter. Forskellen i elektronegativitet er typisk større end 1,7.
* limningstype: Elektrostatisk tiltrækning mellem modsat ladede ioner.
* resulterende forbindelser: Formioniske forbindelser (salte), ofte krystallinske faste stoffer ved stuetemperatur.
* egenskaber:
* høje smelte- og kogepunkter: Stærke elektrostatiske kræfter kræver en masse energi for at bryde.
* ledende, når det er opløst eller smeltet: Frie ioner kan bære elektrisk strøm.
* ofte sprødt: Den stive struktur kan let brud.
Eksempler:
* Natriumchlorid (NaCl) - Natrium mister et elektron for at blive Na⁺, mens klor får et elektron til at blive Cl⁻.
* Magnesiumoxid (MGO) - Magnesium mister to elektroner til at blive Mg²⁺, og ilt får to elektroner til at blive O²⁻.
Nøglepunkt: Klassificeringen af en binding som rent ionisk eller kovalent er ofte en forenkling. Mange obligationer har karakteristika for begge. Udtrykket "polær kovalent" bruges, når der er en ujævn deling af elektroner, hvilket fører til en lidt positiv og lidt negativ ende af molekylet.
 Varme artikler
Varme artikler
-
 Forskere udvikler en optisk sensor, der registrerer meget lave glukosekoncentrationerDen Optiske Forskningsgruppe. Kredit:Universitat Jaume I Den optiske forskningsgruppe fra Universitat Jaume I (GROC-UJI) har udviklet en optisk nanopartikelsensor, der er i stand til at detektere
Forskere udvikler en optisk sensor, der registrerer meget lave glukosekoncentrationerDen Optiske Forskningsgruppe. Kredit:Universitat Jaume I Den optiske forskningsgruppe fra Universitat Jaume I (GROC-UJI) har udviklet en optisk nanopartikelsensor, der er i stand til at detektere -
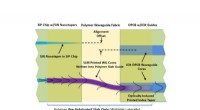 Nye polymermaterialer gør fremstilling af optiske sammenkoblinger nemmereForskere bruger, hvad de kalder en SmartPrint-proces til at udvikle nye polymermaterialer. Kredit:Robert Norwood, University of Arizona Forskere har udviklet nye polymermaterialer, der er ideelle t
Nye polymermaterialer gør fremstilling af optiske sammenkoblinger nemmereForskere bruger, hvad de kalder en SmartPrint-proces til at udvikle nye polymermaterialer. Kredit:Robert Norwood, University of Arizona Forskere har udviklet nye polymermaterialer, der er ideelle t -
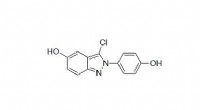 Kemisk forbindelse producerer gavnlig inflammation, remyelinisering, der kan hjælpe med at behandle…Kemisk struktur af indazolchlorid. Kredit:J. Katzenellenbogen, UIUC. Lægemidler til rådighed til behandling af multipel sklerose, en førende årsag til neurologisk handicap, der påvirker omkring 2,
Kemisk forbindelse producerer gavnlig inflammation, remyelinisering, der kan hjælpe med at behandle…Kemisk struktur af indazolchlorid. Kredit:J. Katzenellenbogen, UIUC. Lægemidler til rådighed til behandling af multipel sklerose, en førende årsag til neurologisk handicap, der påvirker omkring 2, -
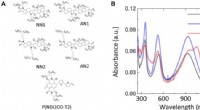 Charge transport fysik af en unik klasse af stive stang-konjugerede polymererKemiske strukturer og tyndfilm UV-Vis-NIR absorptionsspektre. (A) Kemisk struktur af NN1, NN2, AN1, AN2, og P (NDI2OD-T2) polymerer. (B) Tyndfilm UV-Vis-NIR absorptionsspektre af polymererne. Filmene
Charge transport fysik af en unik klasse af stive stang-konjugerede polymererKemiske strukturer og tyndfilm UV-Vis-NIR absorptionsspektre. (A) Kemisk struktur af NN1, NN2, AN1, AN2, og P (NDI2OD-T2) polymerer. (B) Tyndfilm UV-Vis-NIR absorptionsspektre af polymererne. Filmene
- Hvorfor bliver gule frøer mest sandsynligt spist i skoven?
- Er en grundlæggende egenskab ved ledning, der afhænger af ledninger molculær struktur og størrel…
- Hvad dannes, når du blander natriumhydroxid og Epson salt sammen?
- Nanorørs vækst bevæger sig i den rigtige retning
- Hvad er forskellen i et rent stof og en blanding?
- Hvad er betydningen af henfaldskonstanten?


