Hvad er densiteten i G L af klorgas ved 7,50 102 Torr og 25,0ºC molær masse svarer til 70,9 mol?
1. Konverter pres til atmosfærer
* 1 atm =760 torr
* 7,50 x 10² torr * (1 atm / 760 torr) =0,987 atm
2. Konverter temperatur til Kelvin
* K =° C + 273.15
* 25,0 ° C + 273,15 =298,15 K
3. Brug den ideelle gaslov
Den ideelle gaslov er:PV =NRT
* P =tryk (i atm) =0,987 atm
* V =volumen (i L)
* n =mol gas
* R =ideel gaskonstant =0,0821 L ATM/mol k
* T =temperatur (i k) =298,15 k
Vi ønsker at finde densiteten (ρ), som er masse (M) pr. Enhedsvolumen (V):
* ρ =m/v
Vi kan omarrangere den ideelle gaslov for at løse for densitet:
* n/v =p/rt
* Da n =m/m (hvor m er molmasse), kan vi erstatte:
* (m/m)/v =p/rt
* ρ =(m/v) =(pm)/rt
4. Beregn densitet
* ρ =(0,987 atm * 70,9 g/mol)/(0,0821 L ATM/mol K * 298,15 K)
* ρ ≈ 2,84 g/l
Derfor er densiteten af klorgas ved 7,50 x 10² Torr og 25,0 ° C ca. 2,84 g/l.
Sidste artikelHvilken hører ikke uran salt bor brint?
Næste artikelHvordan er hydrogenperoxid skadeligt?
 Varme artikler
Varme artikler
-
 Gør renere, grønnere plast fra affaldsfiskdeleBrug af fiskeolie, forskere har lavet et polyurethan-lignende materiale. Kredit:Mikhailey Wheeler polyurethaner, en type plastik, er næsten overalt - i sko, tøj, køleskabe og byggematerialer. Men
Gør renere, grønnere plast fra affaldsfiskdeleBrug af fiskeolie, forskere har lavet et polyurethan-lignende materiale. Kredit:Mikhailey Wheeler polyurethaner, en type plastik, er næsten overalt - i sko, tøj, køleskabe og byggematerialer. Men -
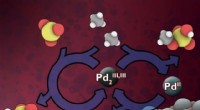 En ny måde at udnytte spildt metan påMIT kemiprofessor Yogesh Surendranath og tre kolleger har fundet en måde at bruge elektricitet på, som potentielt kan komme fra vedvarende kilder, at omdanne metan til derivater af methanol. Forskerne
En ny måde at udnytte spildt metan påMIT kemiprofessor Yogesh Surendranath og tre kolleger har fundet en måde at bruge elektricitet på, som potentielt kan komme fra vedvarende kilder, at omdanne metan til derivater af methanol. Forskerne -
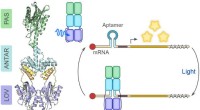 Blåt lys til RNA -kontrolFotoreceptoren PAL binder korte ribonukleinsyrer ved bestråling af blåt lys. Denne lysstyrede aktivitet kan bruges til at regulere RNA-baserede processer, såsom translation. Kredit:© Andreas Möglich/U
Blåt lys til RNA -kontrolFotoreceptoren PAL binder korte ribonukleinsyrer ved bestråling af blåt lys. Denne lysstyrede aktivitet kan bruges til at regulere RNA-baserede processer, såsom translation. Kredit:© Andreas Möglich/U -
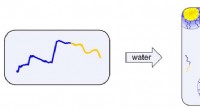 En ny, hurtigere måde at behandle diblok-polymermaterialer påDen blå ende af hver kæde er opløselig i vand, mens den gule ende ikke er det. De gule ender samler sig i et forsøg på at adskille fra vandet. Disse kugleformede klynger kaldes miceller. Kredit:Connor
En ny, hurtigere måde at behandle diblok-polymermaterialer påDen blå ende af hver kæde er opløselig i vand, mens den gule ende ikke er det. De gule ender samler sig i et forsøg på at adskille fra vandet. Disse kugleformede klynger kaldes miceller. Kredit:Connor


