Hvor mange gram ilt er der behov for for at reagere fuldstændigt med 200,0 g ammoniak NH3?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen af ammoniak (NH₃) med ilt (O₂) producerer nitrogengas (N₂) og vand (H₂O):
4 NH₃ + 5 O₂ → 4 NO + 6 H₂O
2. Beregn den molære masse af ammoniak og ilt:
* Molmasse af NH₃ =14,01 g/mol (N) + 3 (1,01 g/mol) (H) =17,04 g/mol
* Molmasse O₂ =2 (16,00 g/mol) (O) =32,00 g/mol
3. Konverter gram af ammoniak til mol:
* Mol nh₃ =(200,0 g nh₃) / (17,04 g / mol nh₃) =11,74 mol nh₃
4. Brug molforholdet fra den afbalancerede ligning:
Den afbalancerede ligning viser, at 4 mol NH₃ reagerer med 5 mol O₂.
* Mol O₂ =(11,74 mol NH₃) * (5 mol O₂ / 4 mol NH₃) =14,68 mol O₂
5. Konverter mol ilt til gram:
* Gram O₂ =(14,68 mol O₂) * (32,00 g/mol O₂) =470,0 g o₂
Derfor har du brug for 470,0 gram ilt for at reagere fuldstændigt med 200,0 gram ammoniak.
Sidste artikelHvilket molekyle i jorden findes nitrogen, når der ikke er ilt rundt?
Næste artikelEr stivelse C6H10O5 ionisk eller kovalent?
 Varme artikler
Varme artikler
-
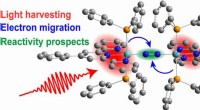 Hvordan sollys giver elektroner energi til at bryde nitrogen og danne ammoniakDen skematiske tegning viser den potentielle aktivering af et nitrogenmolekyle (blå kugler), der er holdt i midten af katalysatoren. Lys høstes (rødt), og elektroner migrerer (blå pile) for i sidste
Hvordan sollys giver elektroner energi til at bryde nitrogen og danne ammoniakDen skematiske tegning viser den potentielle aktivering af et nitrogenmolekyle (blå kugler), der er holdt i midten af katalysatoren. Lys høstes (rødt), og elektroner migrerer (blå pile) for i sidste -
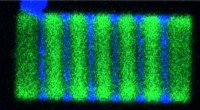 Ny klasse af bløde halvledere kunne transformere HD-skærmeEn 2-D plade, der viser skiftevis cæsium blychlorid (blå) og cæsium blybromid (grøn) segmenter. Kredit:Letian Dou/Berkeley Lab og Connor G. Bischak/UC Berkeley En ny type halvleder kan være på vej
Ny klasse af bløde halvledere kunne transformere HD-skærmeEn 2-D plade, der viser skiftevis cæsium blychlorid (blå) og cæsium blybromid (grøn) segmenter. Kredit:Letian Dou/Berkeley Lab og Connor G. Bischak/UC Berkeley En ny type halvleder kan være på vej -
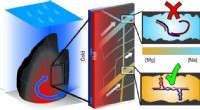 Den rigtige blanding af salte for at komme livet i gangGrafisk abstrakt. Kredit:DOI:10.1038/s41557-021-00772-5 I moderne organismer, det arvelige materiale DNA koder for instruktionerne for syntese af proteiner - de alsidige nanomaskiner, der gør det
Den rigtige blanding af salte for at komme livet i gangGrafisk abstrakt. Kredit:DOI:10.1038/s41557-021-00772-5 I moderne organismer, det arvelige materiale DNA koder for instruktionerne for syntese af proteiner - de alsidige nanomaskiner, der gør det -
 Forskere får en vigtig kemisk forbindelseMetalcarbonylkompleks fyldt i en flaske. Kredit:AG Krossing/J. Bohnenberger Siden opdagelsen af det første homoleptiske metalcarbonylkompleks Ni(CO) 4 for mere end 130 år siden, forskere forsø
Forskere får en vigtig kemisk forbindelseMetalcarbonylkompleks fyldt i en flaske. Kredit:AG Krossing/J. Bohnenberger Siden opdagelsen af det første homoleptiske metalcarbonylkompleks Ni(CO) 4 for mere end 130 år siden, forskere forsø
- Hvordan fugleflokke med flere arter opfører sig som K-pop-grupper
- Selvsamlede aromatiske molekylære stakke, mod modulære molekylære elektroniske komponenter
- Hvad er nogle eksempler på nuklear til elektromagnetisk energi?
- Hvordan genererer solen energi i dag?
- Radar afslører smeltevand året rundt under grønlandsk is
- To mineraler, der krystalliserer ud af grundvandet, er blevet opvarmet af magma?


