Hvilke to atomer ville typisk for en kovalent binding?
Her er hvorfor:
* ikke -metaller Har en høj elektronegativitet, hvilket betyder, at de har en stærk attraktion for elektroner.
* I en kovalent binding deler atomer elektroner For at opnå en stabil elektronkonfiguration (som en ædel gas).
* Da begge ikke -metaller har et stærkt træk på elektroner, er det mere sandsynligt, at de deler snarere end det ene atom, der helt tager et elektron fra det andet (som ville danne en ionisk binding).
Eksempler på atomer, der ofte danner kovalente bindinger:
* brint (H)
* carbon (c)
* ilt (O)
* nitrogen (n)
* fluor (f)
* klor (Cl)
* brom (Br)
* jod (i)
Bemærk: Der er nogle undtagelser fra denne regel. For eksempel kan et metal som bor undertiden danne kovalente bindinger.
Sidste artikelHvad er den ioniske formel for barium og fosfat?
Næste artikelHvad bruges ethanol og ethansyre til?
 Varme artikler
Varme artikler
-
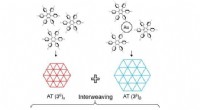 Meget kompleks todimensionel tessellation i den molekylære verdenFigur viser tre typer af meget komplekse sammenvævede tesselleringer baseret på to forskellige molekylære faser konstrueret af en enkelt molekylær byggesten. Kredit:Nature Communications Tessellat
Meget kompleks todimensionel tessellation i den molekylære verdenFigur viser tre typer af meget komplekse sammenvævede tesselleringer baseret på to forskellige molekylære faser konstrueret af en enkelt molekylær byggesten. Kredit:Nature Communications Tessellat -
 Reduktion af den energi, der kræves for at omdanne CO2-affald til værdifulde ressourcerKemisk og biomolekylær ingeniørprofessor og afdelingsformand Paul Kenis, ret, og kandidatstuderende Shawn Lu er medforfattere til en ny undersøgelse, der undersøger gennemførligheden af en ny CO2-sp
Reduktion af den energi, der kræves for at omdanne CO2-affald til værdifulde ressourcerKemisk og biomolekylær ingeniørprofessor og afdelingsformand Paul Kenis, ret, og kandidatstuderende Shawn Lu er medforfattere til en ny undersøgelse, der undersøger gennemførligheden af en ny CO2-sp -
 Forskere observerer katalysator under Fischer-Tropsch-syntese for første gangTestopsætning inklusive højtrykscelle til Fischer-Tropsch-målingskampagnen ved hjælp af CAT-ACT-målelinjen ved KIT-synkrotronen. Kredit:Tiziana Carambia Egnede katalysatorer er af stor betydning f
Forskere observerer katalysator under Fischer-Tropsch-syntese for første gangTestopsætning inklusive højtrykscelle til Fischer-Tropsch-målingskampagnen ved hjælp af CAT-ACT-målelinjen ved KIT-synkrotronen. Kredit:Tiziana Carambia Egnede katalysatorer er af stor betydning f -
 Video:Hvor effektive er stofmasker mod coronavirus?Kredit:The American Chemical Society U.S. Centers for Disease Control anbefaler, at den brede offentlighed bærer ansigtsmasker i stof for at hjælpe med at mindske alles chancer for at få COVID-19.
Video:Hvor effektive er stofmasker mod coronavirus?Kredit:The American Chemical Society U.S. Centers for Disease Control anbefaler, at den brede offentlighed bærer ansigtsmasker i stof for at hjælpe med at mindske alles chancer for at få COVID-19.
- Kom vinden oprindeligt fra solens energi?
- Hvordan kan hastigheden på en mekanisk bølge beregnes?
- Hvordan laver man zink og aluminium på Alchemy Classic?
- Fysikere måler van der Waals kræfter fra individuelle atomer for første gang
- Hvilke naturlige forårsager Carlsbad -huler?
- Eksempler på kemisk energi til lysenergi?


