Hvad er en lonisk forbindelse?
Nøgleegenskaber:
* dannelse: Metaller mister elektroner (danner positivt ladede kationer), og ikke -metaller får elektroner (danner negativt ladede anioner). Den elektrostatiske tiltrækning mellem disse modsatte ladede ioner skaber den ioniske binding.
* struktur: Ioniske forbindelser er normalt arrangeret i et regelmæssigt, gentagne mønster kaldet et krystalgitter. Denne struktur maksimerer tiltrækningen mellem ioner.
* egenskaber:
* høje smelte- og kogepunkter: De stærke elektrostatiske kræfter kræver en masse energi for at bryde.
* gode ledere af elektricitet, når de opløstes i vand eller smeltet: Ionerne er frie til at bevæge sig og bære en elektrisk strøm.
* sprød: Den stive krystalgitterstruktur gør dem tilbøjelige til at bryde, når kraft påføres.
* normalt fast ved stuetemperatur: De stærke kræfter holder ionerne tæt sammen.
Eksempler:
* natriumchlorid (NaCl): Natrium (NA) mister et elektron for at blive Na+, mens klor (CL) får et elektron til at blive Cl-. Disse ioner tiltrækker hinanden og danner bordsalt.
* magnesiumoxid (MGO): Magnesium (Mg) mister to elektroner for at blive Mg2+, mens ilt (O) får to elektroner til at blive O2-.
* kaliumbromid (KBR): Kalium (K) mister et elektron for at blive K+, mens brom (BR) får et elektron til at blive br-.
Kortfattet:
Ioniske forbindelser dannes af den elektrostatiske tiltrækning mellem positivt ladede metalkationer og negativt ladede ikke -metalanioner. De udviser karakteristiske egenskaber på grund af deres stærke ioniske bindinger og krystalgitterstruktur.
Sidste artikelHvad mineral kan ridse sig selv, men ingen anden det?
Næste artikelHvad er oxidationstilstanden for bor i Bo3- 3?
 Varme artikler
Varme artikler
-
 Design af fleksible og strækbare elektroniske enkeltkrystalsystemerYing Diao er interesseret i at udvikle teknikker, der hjælper med fremstilling af elektroniske materialer, energiudstyr, og terapeutiske modeller. Kredit:L. Brian Stauffer, University of Illinois i Ur
Design af fleksible og strækbare elektroniske enkeltkrystalsystemerYing Diao er interesseret i at udvikle teknikker, der hjælper med fremstilling af elektroniske materialer, energiudstyr, og terapeutiske modeller. Kredit:L. Brian Stauffer, University of Illinois i Ur -
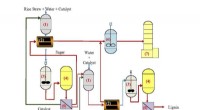 Forskere tager to skridt mod grønt brændstofForskere designet to-trins proces til at nedbryde risstrå til sukker til brændstof. Kredit:Figur tilpasset fra Ind. Eng. Chem. Res. 2019 58 (14), 5686-5697. © 2019 American Chemical Society Et i
Forskere tager to skridt mod grønt brændstofForskere designet to-trins proces til at nedbryde risstrå til sukker til brændstof. Kredit:Figur tilpasset fra Ind. Eng. Chem. Res. 2019 58 (14), 5686-5697. © 2019 American Chemical Society Et i -
 Tarmbakterier er nøglen til fremstilling af universalblodKredit:Wikimedia Commons I januar, rasende storme forårsagede medicinske nødsituationer langs den amerikanske østkyst, får Røde Kors til at udsende en hasteopfordring til bloddonationer. Nationens
Tarmbakterier er nøglen til fremstilling af universalblodKredit:Wikimedia Commons I januar, rasende storme forårsagede medicinske nødsituationer langs den amerikanske østkyst, får Røde Kors til at udsende en hasteopfordring til bloddonationer. Nationens -
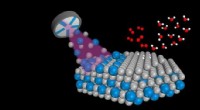 Nanolegeringer 10 gange så effektive som ren platin i brændselscellerNanolegeringer af platin (grå) og yttrium (blå) skabes ved brug af sputtering i et vakuumkammer. Dette gøres ved at rette plasma (lilla) mod et stykke platin med små vedhæftede stykker yttrium. De nan
Nanolegeringer 10 gange så effektive som ren platin i brændselscellerNanolegeringer af platin (grå) og yttrium (blå) skabes ved brug af sputtering i et vakuumkammer. Dette gøres ved at rette plasma (lilla) mod et stykke platin med små vedhæftede stykker yttrium. De nan
- Hvad produceres, når elektroner flyder i ledning?
- En kvanteeffekt gør det muligt at udføre infrarøde målinger ved at detektere synligt lys
- Grønland træder blidt på turismen, mens isbjerge smelter
- Alexa, er du klar til at bo i bilen, også?
- Konverter 290 grader Celsius til Kelvin?
- Astronomer fanger stjernevinde med hidtil usete detaljer


