Hvad har den mindste første ioniseringsenergi Carbonsiliconaluminumboron ud af disse elementer?
Her er hvorfor:
* ioniseringsenergi er den energi, der kræves for at fjerne et elektron fra et atom i sin gasformige tilstand.
* faktorer, der påvirker ioniseringsenergi:
* atomafgift: En højere atomafgift (flere protoner) tiltrækker elektroner stærkere, hvilket gør det sværere at fjerne dem (højere ioniseringsenergi).
* Elektronafskærmning: Elektroner i indre skaller skjuler ydre elektroner fra kernen, hvilket reducerer attraktionen.
* Elektronkonfiguration: Elektroner i højere energiniveau er længere væk fra kernen og lettere at fjerne.
Lad os analysere elementerne:
* bor (b): Har en mindre atomradius og en højere effektiv nuklear ladning sammenlignet med de andre tre elementer. Dette gør det sværere at fjerne en elektron.
* carbon (c): I lighed med bor har den en relativt høj ioniseringsenergi.
* silicium (SI): Større atomradius og lidt mindre effektiv nuklear ladning end bor og kulstof.
* aluminium (AL): Største atomradius ud af de fire elementer. Den yderste elektron i aluminium er længere væk fra kernen og afskærmet af flere indre elektroner. Dette gør det til den nemmeste at fjerne, hvilket resulterer i den laveste ioniseringsenergi.
Derfor har aluminium den mindste første ioniseringsenergi.
Sidste artikelKan svovl udføre elektricitet som et fast stof?
Næste artikelHvad er formlen for sammensat NA4PO4?
 Varme artikler
Varme artikler
-
 At bryde fatbergs op - ingeniører udvikler teknik til at nedbryde fedtstoffer, olie og fedtEn UBC-metode til at nedbryde fedtstoffer, olie og fedt kan bruges i kommunale FOG-styringsprogrammer. Kredit:Clare Kiernan/UBC Madolie og lignende affald kan tilstoppe rør, skade fisk og endda vo
At bryde fatbergs op - ingeniører udvikler teknik til at nedbryde fedtstoffer, olie og fedtEn UBC-metode til at nedbryde fedtstoffer, olie og fedt kan bruges i kommunale FOG-styringsprogrammer. Kredit:Clare Kiernan/UBC Madolie og lignende affald kan tilstoppe rør, skade fisk og endda vo -
 Brug af en blød krystal til at visualisere, hvordan absorberet kuldioxid opfører sig i væskeDen CO2-absorberende bløde krystal udviklet til denne undersøgelse. Kredit:Shin-ichiro Noro Et team af forskere er lykkedes med at visualisere, hvordan kuldioxid (CO 2 ) opfører sig i en ionisk
Brug af en blød krystal til at visualisere, hvordan absorberet kuldioxid opfører sig i væskeDen CO2-absorberende bløde krystal udviklet til denne undersøgelse. Kredit:Shin-ichiro Noro Et team af forskere er lykkedes med at visualisere, hvordan kuldioxid (CO 2 ) opfører sig i en ionisk -
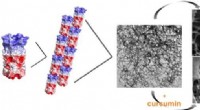 Forskere udvikler termo-responsiv proteinhydrogelEn illustration af, hvordan et konstrueret Q-protein selv samler sig for at danne fiberbaserede hydrogeler ved lav temperatur. Disse hydrogeler har en porøs mikrostruktur, der gør det muligt at bruge
Forskere udvikler termo-responsiv proteinhydrogelEn illustration af, hvordan et konstrueret Q-protein selv samler sig for at danne fiberbaserede hydrogeler ved lav temperatur. Disse hydrogeler har en porøs mikrostruktur, der gør det muligt at bruge -
 Et nyt materiale til fremtidens batteriUCLouvains forskere opdagede et nyt højtydende og sikkert batterimateriale (LTPS), der kan fremskynde opladning og afladning til et niveau, der aldrig er observeret hidtil. Kredit:University of Louvai
Et nyt materiale til fremtidens batteriUCLouvains forskere opdagede et nyt højtydende og sikkert batterimateriale (LTPS), der kan fremskynde opladning og afladning til et niveau, der aldrig er observeret hidtil. Kredit:University of Louvai
- Søger efter tabte uranterninger fra anden verdenskrig fra Tyskland
- Hvilken tørregion danner tilbage på bjerget?
- Har en Nutron positiv eller negativ ladning?
- Hvad er robuste områder med høj elavering?
- Er klorgas en sur eller alkalisk gas?
- Hvilket mål giver dig mulighed for at se det største objektområde er visning i mikroskop?


