1 kg palladiummetal producerer hvor meget chlorid?
* palladiumchlorid er ikke et simpelt produkt af palladiummetal. Reaktionen på dannelse af palladiumchlorid kræver en kemisk reaktion med en klorkilde (som chlorgas eller saltsyre).
* Reaktionsstøkiometrien betyder noget. De specifikke reaktionsbetingelser vil bestemme forholdet mellem palladium og chlorid i den resulterende forbindelse. For eksempel har palladium (II) chlorid (PDCL₂) et andet forhold mellem palladium og chlor end palladium (IV) chlorid (PDCL₄).
For at beregne mængden af produceret chlorid, har du brug for:
1. Den specifikke kemiske reaktion: Hvad er reaktionen fra palladium med klorkilden?
2. den afbalancerede kemiske ligning: Denne ligning viser de nøjagtige molforhold mellem reaktanter og produkter.
3. den ønskede palladiumchloridforbindelse: Leder du efter PDCL₂, PDCL₄ eller en anden forbindelse?
Eksempel:
Lad os sige, at du reagerer palladiummetal med klorgas for at producere palladium (II) chlorid (PDCL₂):
* afbalanceret ligning: PD + CL₂ → PDCL₂
* Molær masse af PD: 106,42 g/mol
* Molmasse af Cl₂: 70,90 g/mol
* Molær masse af PDCL₂: 177,32 g/mol
Fra den afbalancerede ligning reagerer 1 mol PD med 1 mol CL₂ for at producere 1 mol PDCl₂.
Beregninger:
1. mol PD: (1 kg PD) / (106,42 g / mol) =9,40 mol PD
2. mol PDCL₂: 9,40 mol pd * (1 mol pdcl₂ / 1 mol pd) =9,40 mol pdcl₂
3. masse af pdcl₂: 9,40 mol pdcl₂ * (177,32 g/mol) =1668 g pdcl₂
Derfor ville 1 kg palladium i denne specifikke reaktion producere ca. 1,67 kg palladium (II) chlorid.
Husk: Dette er bare et eksempel. Du skal justere beregningerne baseret på den faktiske reaktion, du bruger.
Sidste artikelHvad er produktet af reaktion mellem ethen og forsuret kaliummanganat 7?
Næste artikelHvor mange atomer er der i 3C6H8O7?
 Varme artikler
Varme artikler
-
 Udvikling af nye måder at fremme kobberproduktion påEn prøve af næsten rent kobber aflejres på en jernelektrode efter ekstraktion gennem en elektrokemisk proces udviklet af forskere i laboratoriet hos MIT-lektor Antoine Allanore. Kredit:Denis Paiste/Ma
Udvikling af nye måder at fremme kobberproduktion påEn prøve af næsten rent kobber aflejres på en jernelektrode efter ekstraktion gennem en elektrokemisk proces udviklet af forskere i laboratoriet hos MIT-lektor Antoine Allanore. Kredit:Denis Paiste/Ma -
 Forskere strømliner molekylært samlebånd til design, test lægemiddelforbindelserKredit:Lenny Kuhne/Unsplash Forskere fra North Carolina State University har fundet en måde at finjustere det molekylære samlebånd, der skaber antibiotika via manipuleret biosyntese. Arbejdet kunn
Forskere strømliner molekylært samlebånd til design, test lægemiddelforbindelserKredit:Lenny Kuhne/Unsplash Forskere fra North Carolina State University har fundet en måde at finjustere det molekylære samlebånd, der skaber antibiotika via manipuleret biosyntese. Arbejdet kunn -
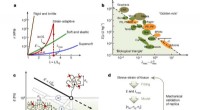 Kode til finjustering af elastomerer for at efterligne biologiske materialerProgrammering af mekanisk ydeevne. en, Den mekaniske mangfoldighed af biologiske og syntetiske materialer er illustreret ved enaksede trækspænding-deformationskurver, som afslører kombinationer af ege
Kode til finjustering af elastomerer for at efterligne biologiske materialerProgrammering af mekanisk ydeevne. en, Den mekaniske mangfoldighed af biologiske og syntetiske materialer er illustreret ved enaksede trækspænding-deformationskurver, som afslører kombinationer af ege -
 Det biologisk nedbrydelige batteri, der er 3D-printet, engangs og lavet af papirDet biologisk nedbrydelige batteri består af fire lag, alle flyder ud af en 3D-printer efter hinanden. Det hele bliver så foldet sammen som en sandwich, med elektrolytten i midten. Billede:Gian Vaitl
Det biologisk nedbrydelige batteri, der er 3D-printet, engangs og lavet af papirDet biologisk nedbrydelige batteri består af fire lag, alle flyder ud af en 3D-printer efter hinanden. Det hele bliver så foldet sammen som en sandwich, med elektrolytten i midten. Billede:Gian Vaitl
- Hvis en studerende rejser 20 meter på 5 sekunder, hvad er de studerendes hastighed?
- Nerveindpakning nanofiber mesh, der fremmer regenerering
- Det nukleare brændstof i solen er?
- Sådan tolk hierarkisk regression
- Registrering af deepfake -videoer på et øjeblik
- Ny forskning afslører, hvorfor hvalsangkulturen er forskellig mellem den nordlige og den sydlige ha…


