Forskere strømliner molekylært samlebånd til design, test lægemiddelforbindelser

Kredit:Lenny Kuhne/Unsplash
Forskere fra North Carolina State University har fundet en måde at finjustere det molekylære samlebånd, der skaber antibiotika via manipuleret biosyntese. Arbejdet kunne give videnskabsfolk mulighed for at forbedre eksisterende antibiotika samt designe nye lægemiddelkandidater hurtigt og effektivt.
Bakterier - som f.eks E coli — udnytte biosyntese til at skabe molekyler, der er svære at fremstille kunstigt.
"Vi bruger allerede bakterier til at lave en række lægemidler til os, " siger Edward Kalkreuter, tidligere kandidatstuderende ved NC State og hovedforfatter på et papir, der beskriver forskningen. "Men vi ønsker også at lave ændringer i disse forbindelser; f.eks. der er meget lægemiddelresistens over for erythromycin. At være i stand til at lave molekyler med lignende aktivitet, men forbedret effektivitet mod resistens er det generelle mål."
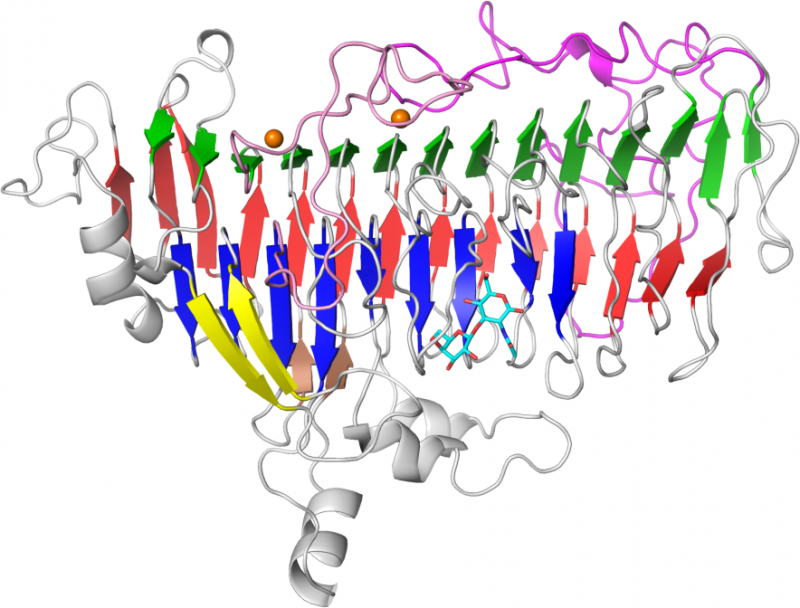
Forestil dig et samlebånd til biler:Hvert stop langs linjen har en robot, der vælger et bestemt stykke af bilen og tilføjer det til helheden. Erstat nu bilen med erythromycin, og en acyltransferase (AT) - et enzym - som robotten på stationerne langs samlebåndet. Hver AT "robot" vil vælge en kemisk blok, eller forlænger enhed, at tilføje til molekylet. På hver station har AT-robotten 430 aminosyrer, eller rester, som hjælper den med at vælge, hvilken forlængerenhed der skal tilføjes.
"Forskellige typer forlængerenheder påvirker molekylets aktivitet, " siger Gavin Williams, professor i kemi, LORD Corporation Distinguished Scholar ved NC State og tilsvarende forfatter til forskningen. "At identificere de rester, der påvirker udvælgelsen af forlængerenhed, er en måde at skabe molekyler med den aktivitet, vi ønsker."
Holdet brugte molekylær dynamiske simuleringer til at undersøge AT-rester og identificerede 10 rester, der signifikant påvirker udvælgelsen af forlængerenhed. De udførte derefter massespektrometri og in vitro-testning på AT-enzymer, som fik disse rester ændret for at bekræfte, at deres aktivitet også var ændret. Resultaterne understøttede computersimuleringens forudsigelser.
"Disse simuleringer forudsiger, hvilke dele af enzymet vi kan ændre ved at vise, hvordan enzymet bevæger sig over tid, " siger Kalkreuter. "Generelt, folk ser på statisk, ikke-bevægelige strukturer af enzymer. Det gør det svært at forudsige, hvad de gør, fordi enzymer ikke er statiske i naturen. Forud for dette arbejde, meget få rester blev antaget eller kendt for at påvirke valget af forlængerenhed."
Williams tilføjer, at manipulation af rester giver mulighed for meget større præcision ved omprogrammering af det biosyntetiske samlebånd.
"Tidligere forskere, der ønskede at ændre et antibiotikums struktur, ville simpelthen bytte hele AT-enzymet ud, " siger Williams. "Det svarer til at fjerne en hel robot fra samlebåndet. Ved at fokusere på resterne, vi erstatter blot fingrene på den arm – som at omprogrammere en arbejdsstation i stedet for at fjerne den. Det giver mulighed for meget større præcision.
"At bruge disse beregningssimuleringer til at finde ud af, hvilke rester der skal erstattes, er et andet værktøj i værktøjskassen for forskere, der bruger bakterier til at biosyntetisere lægemidler."
 Varme artikler
Varme artikler
-
 Forskere finder, at frøskal kunne føre til stærke, hård, men alligevel fleksible materialerKarakteristiske træk ved frøkappen af Portulaca oleracea , en årlig sukkulent almindeligvis kendt som verdolaga eller portulak. A) Foto af P. oleracea blomst , B) Fotografi af de bittesmå sorte fr
Forskere finder, at frøskal kunne føre til stærke, hård, men alligevel fleksible materialerKarakteristiske træk ved frøkappen af Portulaca oleracea , en årlig sukkulent almindeligvis kendt som verdolaga eller portulak. A) Foto af P. oleracea blomst , B) Fotografi af de bittesmå sorte fr -
 Hvordan en gavnlig tarmmikrobe tilpasser sig modermælkMolekylær struktur af lacto-N-biosidase LnbX, et enzym fra en symbiotisk bakterie (B. longum) i spædbørns tarm til at nedbryde sukker i modermælken. Kredit:Yamada og Gotoh et al. Modermælk giver v
Hvordan en gavnlig tarmmikrobe tilpasser sig modermælkMolekylær struktur af lacto-N-biosidase LnbX, et enzym fra en symbiotisk bakterie (B. longum) i spædbørns tarm til at nedbryde sukker i modermælken. Kredit:Yamada og Gotoh et al. Modermælk giver v -
 At vende et materiale på hovedet kan nogle gange gøre det blødereKunstnerisk fremstilling af det nye materiale. Kredit:ICN2 Gennem den kombinerede effekt af flexoelektricitet og piezoelektricitet, forskere ved ICN2 ledet af ICREA Gustau Catalán i samarbejde med
At vende et materiale på hovedet kan nogle gange gøre det blødereKunstnerisk fremstilling af det nye materiale. Kredit:ICN2 Gennem den kombinerede effekt af flexoelektricitet og piezoelektricitet, forskere ved ICN2 ledet af ICREA Gustau Catalán i samarbejde med -
 Ny teknik til at studere rustning af stål gavner mineindustrienArthur Situm ved den canadiske lyskildesynkrotron. Kredit:Dave Stobbe University of Saskatchewan (USask) Ph.D. studerende Arthur Situm har udviklet en ny ikke-invasiv teknik til at studere rusten
Ny teknik til at studere rustning af stål gavner mineindustrienArthur Situm ved den canadiske lyskildesynkrotron. Kredit:Dave Stobbe University of Saskatchewan (USask) Ph.D. studerende Arthur Situm har udviklet en ny ikke-invasiv teknik til at studere rusten
- Jordporer, kulstoflagre, og vejrtrækningsmikrober
- Eksperiment forbedrer forudsigelser af uraniumspredning
- Ruslands rumfartsagentur siger fejl i bemandet Sojuz-landing
- Hot pots hjalp gamle sibiriske jægere med at overleve istiden
- Standardform for en lineær ligning
- Ny rapport advarer om farer for Great Lakes sundhed og økonomi som følge af klimaændringer


