Hvor mange atomer af svovl er der i 1 g?
* svovl findes i forskellige former: Svovl kan eksistere som elementært svovl (S8), sulfider (som jernsulfid, FES), sulfater (som calciumsulfat, CASO4) og andre forbindelser.
* atommasse er nøglen: Antallet af atomer i en given masse afhænger af elementets atommasse. Svovl har en atommasse på ca. 32,06 g/mol.
For at beregne antallet af svovlatomer skal du følge disse trin:
1. Identificer formen af svovl: Er det elementært svovl (S8), et specifikt sulfid, sulfat eller en anden svovlholdig forbindelse?
2. Beregn den molære masse: Bestem den molære masse af den specifikke form for svovl. For eksempel for elementært svovl (S8) er den molære masse 8 * 32,06 g/mol =256,48 g/mol.
3. Konverter gram til mol: Del den givne masse (1 g) med den molære masse. For eksempel 1 g / 256,48 g / mol =0,0039 mol S8.
4. Brug Avogadro's nummer: Multiplicer antallet af mol med Avogadros nummer (6.022 x 10^23 atomer/mol) for at finde antallet af atomer. For eksempel 0,0039 mol * 6,022 x 10^23 atomer/mol =2,35 x 10^21 atomer af S8.
Eksempel:
Hvis du har 1 gram elementært svovl (S8):
* Den molære masse af S8 er 256,48 g/mol.
* 1 g S8 er lig med 1 g / 256,48 g / mol =0,0039 mol S8.
* 0,0039 mol S8 indeholder 0,0039 mol * 6,022 x 10^23 atomer/mol =2,35 x 10^21 atomer svovl.
Derfor skal du kende den specifikke form for svovl for at bestemme antallet af svovlatomer i 1 gram
 Varme artikler
Varme artikler
-
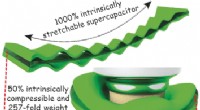 Super strækbar, superkomprimerbare superkondensatorerFleksibel, bærbar elektronik kræver lige så fleksibel, bærbare strømkilder. I journalen Angewandte Chemie , Kinesiske videnskabsmænd har introduceret en ekstraordinært strækbar og komprimerbar polye
Super strækbar, superkomprimerbare superkondensatorerFleksibel, bærbar elektronik kræver lige så fleksibel, bærbare strømkilder. I journalen Angewandte Chemie , Kinesiske videnskabsmænd har introduceret en ekstraordinært strækbar og komprimerbar polye -
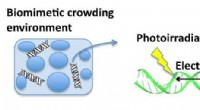 Elektronoverførsel og oxidativ skade i DNA i et biomimetisk trængselmiljøKredit:University of Electro Communications Det er kendt, at et elektronhul bevæger sig gennem dobbeltspiralformet DNA og inducerer oxidativ skade på guaninsteder. Til dato, denne proces er kun bl
Elektronoverførsel og oxidativ skade i DNA i et biomimetisk trængselmiljøKredit:University of Electro Communications Det er kendt, at et elektronhul bevæger sig gennem dobbeltspiralformet DNA og inducerer oxidativ skade på guaninsteder. Til dato, denne proces er kun bl -
 Biologisk fyrværkeri viser 300 millioner år undervejsFrøæg som dem, der er afbildet her, frigiver zink, når de befrugtes, ligesom pattedyræg gør. Kredit:Tero Laakso/licenseret under CC BY-SA 2.0. Fem år siden, forskere ved Northwestern University la
Biologisk fyrværkeri viser 300 millioner år undervejsFrøæg som dem, der er afbildet her, frigiver zink, når de befrugtes, ligesom pattedyræg gør. Kredit:Tero Laakso/licenseret under CC BY-SA 2.0. Fem år siden, forskere ved Northwestern University la -
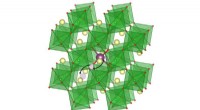 Lithium-ioner strømmer gennem fast materialeLithiumioner diffunderer hurtigt inden for gitteret af en stærkt korreleret perovskit kaldet samariumnikkelat. Kvanteberegninger viser, at denne hurtige shuttle opstår på grund af den lave termodynami
Lithium-ioner strømmer gennem fast materialeLithiumioner diffunderer hurtigt inden for gitteret af en stærkt korreleret perovskit kaldet samariumnikkelat. Kvanteberegninger viser, at denne hurtige shuttle opstår på grund af den lave termodynami
- Forskning afslører betydelige virkninger af undervisere på skærmen under videotimer for at hjælp…
- Indespærret i små kulstof nanorør, ekstremt koldt vands molekyler stiller op i en højt ordnet kæ…
- Hvad er rækkefølgen af alle planter og soler fra størst til mindste?
- Sådan beregnes FXY Partial Derivatives
- Hvad skal man gøre i en kemi -lektion?
- Hvordan ændres partikelbevægelse og temperatur, da et materiale absorberer varme?


