Hvorfor fluor er stærkere oxideringsmiddel end klor?
1. Mindre atomstørrelse og højere elektronegativitet:
* mindre størrelse: Fluor har en mindre atomradius end klor. Dette betyder, at dens valenselektroner er tættere på kernen og oplever en stærkere attraktion.
* Højere elektronegativitet: Fluor er det mest elektronegative element, hvilket betyder, at det har et stærkere træk på delte elektroner i en binding.
2. Lavere ioniseringsenergi:
Fluor har en lavere ioniseringsenergi sammenlignet med klor. Dette betyder, at det kræver mindre energi for at fjerne et elektron fra et fluoratom, hvilket gør det lettere at få et elektron og fungere som oxidationsmiddel.
3. Svagere F-F-obligation:
F-F-bindingen er relativt svag sammenlignet med CL-CL-bindingen. Dette skyldes den lille størrelse af fluoratomer, hvilket fører til signifikant elektronelektronafvisning mellem de ensomme par. Den svagere binding gør det lettere for fluor at bryde fra hinanden og danne nye bindinger med andre elementer, der fungerer som en kraftig oxidation.
4. Fravær af d-orbitaler:
Fluor har ingen D-orbitaler i sin valensskal, i modsætning til klor. Dette begrænser fluorens evne til at udvide sin oktet og deltage i reaktioner, der involverer højere oxidationstilstande. Følgelig foretrækker fluor primært at få en elektron, hvilket gør det til en potent oxidation.
I resuméet bidrager fluorens mindre størrelse, højere elektronegativitet, lavere ioniseringsenergi, svag F-F-binding og mangel på D-orbitaler alle til dens ekstraordinære oxidationsevne, hvilket gør det stærkere end klor.
Sidste artikelHvad er formlen for kovalent sammensat svovl -dibromid?
Næste artikelHvad er anvendelsen af carbonhydroxid?
 Varme artikler
Varme artikler
-
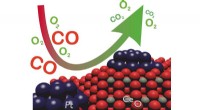 Dynamiske katalysatorer til ren luft i byenEn bils katalysator omdanner giftigt kulilte (CO) til giftfri kuldioxid (CO2) og består af cerium (Ce), ilt (O), og platin (Pt). Kredit:Gänzler/KIT Reduktion af forurenende emissioner af køretøjer
Dynamiske katalysatorer til ren luft i byenEn bils katalysator omdanner giftigt kulilte (CO) til giftfri kuldioxid (CO2) og består af cerium (Ce), ilt (O), og platin (Pt). Kredit:Gänzler/KIT Reduktion af forurenende emissioner af køretøjer -
 Vand kan være nøglen til at forstå sødmeKredit:American Chemical Society Et tranebær, honning eller en slikbar - hvad smager sødest? Disse fødevarer indeholder sukkerarter, som mennesker kan opfatte forskelligt. Et tranebær virker syrli
Vand kan være nøglen til at forstå sødmeKredit:American Chemical Society Et tranebær, honning eller en slikbar - hvad smager sødest? Disse fødevarer indeholder sukkerarter, som mennesker kan opfatte forskelligt. Et tranebær virker syrli -
 Metalisk femleddet ring flytter grænserne for aromaticitetProf. Dr. Robert Kretschmer, professor i uorganisk kemi ved Chemnitz University of Technology, undersøger krystaller foran et diffraktometer. Kredit:Jacob Müller | Chemnitz teknologiske universitet
Metalisk femleddet ring flytter grænserne for aromaticitetProf. Dr. Robert Kretschmer, professor i uorganisk kemi ved Chemnitz University of Technology, undersøger krystaller foran et diffraktometer. Kredit:Jacob Müller | Chemnitz teknologiske universitet -
 Revner i perovskitfilm til solceller kan let heles, undersøgelse finderEn revnet perovskitfilm (til venstre) kan heles fuldstændigt (højre) med en vis komprimering af lidt varme, ny forskning viser. Resultaterne lover godt for den langsigtede pålidelighed af perovskitfil
Revner i perovskitfilm til solceller kan let heles, undersøgelse finderEn revnet perovskitfilm (til venstre) kan heles fuldstændigt (højre) med en vis komprimering af lidt varme, ny forskning viser. Resultaterne lover godt for den langsigtede pålidelighed af perovskitfil
- Millihertz kvasi-periodiske oscillationer detekteret i den binære røntgenstråle EXO 0748−676
- Hvilke to andre kroppe bevæger sig rundt om solen?
- Data fra antipodale steder:Første brug af CMB-polarisering til at detektere gravitationslinser fra …
- Hvad kaldes testen for brintgas?
- Sådan laver du en stærk bro ud af popsicle sticks
- Ultrahurtig verden fanget med ultratynde film


