Hvad er kvantetalene for kobolt?
forståelse af kvantetal
* hovedkantenummer (n): Beskriver elektronskallens energiniveau. Værdier er heltal som 1, 2, 3 osv. (N =1, 2 og ∞ svarer til henholdsvis K-, L- og ioniseringsniveauerne).
* vinkelmomentum eller azimuthal kvantetal (L): Beskriver formen på en elektrons orbital. Værdier varierer fra 0 til (n-1).
* L =0:S Orbital (sfærisk)
* L =1:P orbitaler (håndvægtformet)
* L =2:D Orbitals (mere komplekse former)
* l =3:f orbitaler (endnu mere komplekse former)
* Magnetisk kvantenummer (ML): Beskriver orienteringen af en orbital i rummet. Værdier spænder fra -l til +l, inklusive 0.
* spin kvantenummer (MS): Beskriver den iboende vinkelmoment for et elektron, der er kvantiseret og har en værdi på +1/2 eller -1/2.
Elektronkonfiguration af kobolt
Cobalt's elektronkonfiguration er:1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D⁷
kvantetal til Cobalts elektroner
Her er en oversigt over kvantetalene for hver elektron i kobolt:
| shell | n | l | ml | ms |
| --- | --- | --- | --- | --- |
| 1S | 1 | 0 | 0 | +1/2 |
| 1S | 1 | 0 | 0 | -1/2 |
| 2s | 2 | 0 | 0 | +1/2 |
| 2s | 2 | 0 | 0 | -1/2 |
| 2P | 2 | 1 | -1 | +1/2 |
| 2P | 2 | 1 | 0 | +1/2 |
| 2P | 2 | 1 | +1 | +1/2 |
| 2P | 2 | 1 | -1 | -1/2 |
| 2P | 2 | 1 | 0 | -1/2 |
| 2P | 2 | 1 | +1 | -1/2 |
| 3S | 3 | 0 | 0 | +1/2 |
| 3S | 3 | 0 | 0 | -1/2 |
| 3P | 3 | 1 | -1 | +1/2 |
| 3P | 3 | 1 | 0 | +1/2 |
| 3P | 3 | 1 | +1 | +1/2 |
| 3P | 3 | 1 | -1 | -1/2 |
| 3P | 3 | 1 | 0 | -1/2 |
| 3P | 3 | 1 | +1 | -1/2 |
| 4S | 4 | 0 | 0 | +1/2 |
| 4S | 4 | 0 | 0 | -1/2 |
| 3d | 3 | 2 | -2 | +1/2 |
| 3d | 3 | 2 | -1 | +1/2 |
| 3d | 3 | 2 | 0 | +1/2 |
| 3d | 3 | 2 | +1 | +1/2 |
| 3d | 3 | 2 | +2 | +1/2 |
| 3d | 3 | 2 | -2 | -1/2 |
| 3d | 3 | 2 | -1 | -1/2 |
Vigtig note: De specifikke værdier for ML og MS for 3D -elektronerne kan være lidt forskellige afhængigt af den specifikke elektroniske tilstand af koboltatomet. Dette skyldes Hunds regel, der siger, at elektroner vil udfylde orbitaler individuelt, før de parrer sig.
Sidste artikelHvad er nogle af de anvendte Morganite?
Næste artikelHvad er elementet i C15H22Cino2?
 Varme artikler
Varme artikler
-
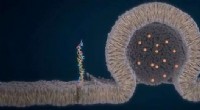 Sådan dannes en kanal mellem to organellerKreditering:Je-Kyung Ryu Kanalen, gennem hvilken to cellekomponenter udveksler materiale, ser ud til at dannes ved kanten af deres kontaktflade, og ikke i midten. Dette blev opdaget af de Leiden
Sådan dannes en kanal mellem to organellerKreditering:Je-Kyung Ryu Kanalen, gennem hvilken to cellekomponenter udveksler materiale, ser ud til at dannes ved kanten af deres kontaktflade, og ikke i midten. Dette blev opdaget af de Leiden -
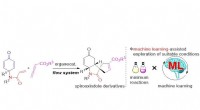 En vanskelig reaktionssekvens får et stort løft fra et flow-opsætning og statistikMaskinstøttet udforskning af organokatalyseret dominoreaktion i flowsystem. Kredit:Royal Society of Chemistry Forskere fra Osaka University optimerer en kompliceret dominoreaktion i et flowsystem
En vanskelig reaktionssekvens får et stort løft fra et flow-opsætning og statistikMaskinstøttet udforskning af organokatalyseret dominoreaktion i flowsystem. Kredit:Royal Society of Chemistry Forskere fra Osaka University optimerer en kompliceret dominoreaktion i et flowsystem -
 Papir dokumenterer selvhelende membran til brændselscelle applikationerUniversity of Delaware forskere har udviklet en selvhelbredende membran til brændselsceller. Kredit:Kathy F. Atkinson, University of Delaware Brændselsceller er energieffektive og rene. Imidlertid
Papir dokumenterer selvhelende membran til brændselscelle applikationerUniversity of Delaware forskere har udviklet en selvhelbredende membran til brændselsceller. Kredit:Kathy F. Atkinson, University of Delaware Brændselsceller er energieffektive og rene. Imidlertid -
 Forskere foreslår ny koblingsstrategi for organisk spildevandsrensningGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121858 En fælles forskergruppe ledet af prof. Sun Chenglin, prof. Wei Huangzhao og prof. Li Rengui fra Dalian Ins
Forskere foreslår ny koblingsstrategi for organisk spildevandsrensningGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121858 En fælles forskergruppe ledet af prof. Sun Chenglin, prof. Wei Huangzhao og prof. Li Rengui fra Dalian Ins
- Hvilket rum ville have den højeste gennemsnitlige kinetiske energi?
- Hvad sker der med jordskorpe efter jordskælv?
- Hvad er den kraft, der skal til for at affyre en 9 mm kugle?
- Hvad er mere flydende 750 ml eller 1,5L?
- Sådan reduceres spænding med modstande
- Lavfrekvente havlyde ringer klart i store højder


