Hvordan producerer baser hydroxidioner?
1. Arrhenius baser:
* Definition: Dette er stoffer, der producerer hydroxidioner (OH-), når de opløses i vand.
* mekanisme: De adskiller sig direkte i vand og frigiver ohioner.
* Eksempel: Natriumhydroxid (NaOH) opløses i vand til dannelse af natriumioner (Na+) og hydroxidioner (OH-):
`` `
NaOH (s) → Na + (aq) + OH- (aq)
`` `
2. Brønsted-lowry baser:
* Definition: Dette er stoffer, der accepterer protoner (H+).
* mekanisme: De reagerer med vandmolekyler, accepterer en proton (H+) og efterlader en hydroxidion (OH-).
* Eksempel: Ammoniak (NH3) reagerer med vand til dannelse af ammoniumioner (NH4+) og hydroxidioner (OH-):
`` `
NH3 (aq) + H2O (L) ⇌ NH4 + (aq) + OH- (aq)
`` `
3. Lewis baser:
* Definition: Dette er stoffer, der donerer et par elektroner.
* mekanisme: De kan reagere med vand og donere et par elektroner til et hydrogenatom i et vandmolekyle, hvilket fører til dannelse af hydroxidioner (OH-).
* Eksempel: Oxidionen (O2-) fungerer som en Lewis-base og reagerer med vand:
`` `
O2- (aq) + H2O (L) → 2OH- (aq)
`` `
Sammenfattende producerer baser hydroxidioner gennem:
* Direkte dissociation i vand (Arrhenius baser)
* Accept af protoner fra vand (Brønsted-Lowry-baser)
* Donation af elektronpar til vand (Lewis -baser)
Det er vigtigt at bemærke, at ikke alle baser er stærke elektrolytter. Mens stærke baser fuldt ud ioniserer i opløsningen, ioniserer svage baser kun delvist, hvilket resulterer i en lavere koncentration af hydroxidioner.
 Varme artikler
Varme artikler
-
 Hurtig screening for potentielle nye katalysatorerAlan Savan (til venstre) og Tobias Löffler analyserer legeringer med høj entropi. Kredit:RUB, Marquard Et nyt koncept gør det muligt at identificere de mest lovende blandt en overflod af mulige el
Hurtig screening for potentielle nye katalysatorerAlan Savan (til venstre) og Tobias Löffler analyserer legeringer med høj entropi. Kredit:RUB, Marquard Et nyt koncept gør det muligt at identificere de mest lovende blandt en overflod af mulige el -
 Velcro-lignende madsensor registrerer fordærv og forureningDen velcro-lignende madsensor, lavet af en række silkemikronåle, kan stikke gennem plastikemballage for at prøve mad for tegn på fordærv og bakteriel forurening. Kredit:Felice Frankel MIT ingeniør
Velcro-lignende madsensor registrerer fordærv og forureningDen velcro-lignende madsensor, lavet af en række silkemikronåle, kan stikke gennem plastikemballage for at prøve mad for tegn på fordærv og bakteriel forurening. Kredit:Felice Frankel MIT ingeniør -
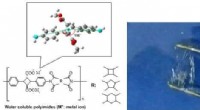 Højtermoresistente biopolyimider bliver vandopløselige som stivelseStrukturer af vandopløselige biopolyimider afledt af 4, 4-diaminotruxillinsyresalt med let bøjet struktur (model i toppen) og forskellige dianhydrider (venstre strukturer). Vandopløsende adfærd (højre
Højtermoresistente biopolyimider bliver vandopløselige som stivelseStrukturer af vandopløselige biopolyimider afledt af 4, 4-diaminotruxillinsyresalt med let bøjet struktur (model i toppen) og forskellige dianhydrider (venstre strukturer). Vandopløsende adfærd (højre -
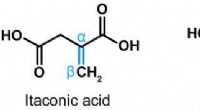 Cellebeskyttelse, immunmodulering og virushæmning af et endogent stofStrukturer af isomererne af itaconsyre. Kredit:CC-BY F. Chen et al. Det endogene molekyle itaconsyre har antivirale og antiinflammatoriske virkninger, som forskere fra TWINCORE for nylig har vist.
Cellebeskyttelse, immunmodulering og virushæmning af et endogent stofStrukturer af isomererne af itaconsyre. Kredit:CC-BY F. Chen et al. Det endogene molekyle itaconsyre har antivirale og antiinflammatoriske virkninger, som forskere fra TWINCORE for nylig har vist.


