Er hydrogensulfid en stærk syre?
Her er hvorfor:
* ionisering: Mens H₂s kan donere en proton (H⁺) til dannelse af hydrosulfidion (HS⁻), gør det det kun i en begrænset grad i opløsning.
* ligevægt: Ioniseringsreaktionen af H₂S er en ligevægtsreaktion, der favoriserer det uudskillede H₂S -molekyle. Dette betyder, at de fleste af H₂S -molekylerne forbliver intakte i opløsningen.
* syre dissociation konstant (KA): Ka -værdien for H₂S er meget lille (ca. 1 x 10⁻⁷), hvilket indikerer, at den er en svag syre. En mindre Ka -værdi betyder, at syren ioniserer mindre let.
I modsætning hertil stærke syrer Ligesom saltsyre (HCI) ioniserer helt i opløsning, hvilket betyder, at de let donerer alle deres protoner.
Sidste artikelEr natriumchlorid og kalium isomorf?
Næste artikelVil ammoniak og frostvæske blandes som det gør med vand?
 Varme artikler
Varme artikler
-
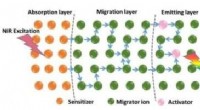 Netop skræddersy dynamikken ved opkonverteringens luminescensOpkonverteringsprocessen i dopantionerne rumligt adskilte nanostruktur. Her, de tre grundlæggende processer for fotonabsorption, energi migration, og UC -emission, er rumligt adskilt. Kredit:HIMS
Netop skræddersy dynamikken ved opkonverteringens luminescensOpkonverteringsprocessen i dopantionerne rumligt adskilte nanostruktur. Her, de tre grundlæggende processer for fotonabsorption, energi migration, og UC -emission, er rumligt adskilt. Kredit:HIMS -
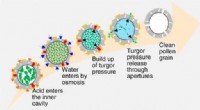 Rensning af pollenskallerKredit:American Chemical Society Efterhånden som allergisæsonen intensiveres, mange mennesker forbander pollen - det pulveragtige stof, der frigives af planter til reproduktion. Imidlertid, pollen
Rensning af pollenskallerKredit:American Chemical Society Efterhånden som allergisæsonen intensiveres, mange mennesker forbander pollen - det pulveragtige stof, der frigives af planter til reproduktion. Imidlertid, pollen -
 Ingeniører forvandler plastisolator til varmelederForskere på MIT har designet en ny måde at konstruere en polymerstruktur på molekylært niveau, via kemisk dampaflejring. Dette giver mulighed for stive, bestilte kæder, kontra det rodede, spaghetti-li
Ingeniører forvandler plastisolator til varmelederForskere på MIT har designet en ny måde at konstruere en polymerstruktur på molekylært niveau, via kemisk dampaflejring. Dette giver mulighed for stive, bestilte kæder, kontra det rodede, spaghetti-li -
 Selvkomprimerende beton bliver mere bæredygtig takket være at bruge granitresterEn UCO-undersøgelse beviser muligheden for at erstatte op til 40% af konventionelle tilslag af selvkomprimerende mørtel med granitslam, dermed reducere byggesektorens miljøbelastning. Kredit:Universit
Selvkomprimerende beton bliver mere bæredygtig takket være at bruge granitresterEn UCO-undersøgelse beviser muligheden for at erstatte op til 40% af konventionelle tilslag af selvkomprimerende mørtel med granitslam, dermed reducere byggesektorens miljøbelastning. Kredit:Universit
- Australien forstærker teknologien til nedkæmpelse af drone
- Har en elektron samme hastighed som en proton?
- Når en kraft påføres, der bevæger et objekt i retning af, hvad der er gjort?
- Hvad er bølgetalet i fysik?
- Opløses sukker hurtigere end salt, når alle andre variabler er de samme?
- Massiv Sahara-støvfane på vej mod det sydøstlige USA, kunne bringe sensationelle solnedgange


