Den mest almindelige oxidationstilstand af elementer i gruppe 2A ville være?
Her er hvorfor:
* Elektronisk konfiguration: Gruppe 2A -elementer har to valenselektroner (elektroner i deres yderste skal).
* tendens til at miste elektroner: De har en stærk tendens til at miste disse to valenselektroner for at opnå en stabil, ædelgaskonfiguration.
* Dannelse af kationer: At miste to elektroner resulterer i dannelsen af en +2 -kation.
Eksempler:
* beryllium (BE): Være 2+
* magnesium (mg): Mg 2+
* calcium (CA): CA 2+
* strontium (SR): Sr 2+
* barium (BA): Ba 2+
* radium (RA): Ra 2+
Mens nogle tungere alkaliske jordmetaller kan udvise andre oxidationstilstande under specifikke forhold, er +2 den mest almindelige og stabile tilstand.
Sidste artikelHvad er den kemiske reaktion mellem calciumcarbonat og mælk?
Næste artikelHar sur regn en lav pH?
 Varme artikler
Varme artikler
-
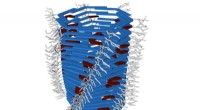 Forskere udvikler en ny type syntetisk molekylær maskineTubuline. Kredit:University of Twente Forskere ved University of Twentes forskningsinstitut MESA+ konstruerer molekylære maskiner, der er i stand til at udøve en målbar kraft på nanoskala og i fly
Forskere udvikler en ny type syntetisk molekylær maskineTubuline. Kredit:University of Twente Forskere ved University of Twentes forskningsinstitut MESA+ konstruerer molekylære maskiner, der er i stand til at udøve en målbar kraft på nanoskala og i fly -
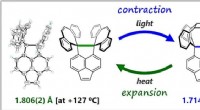 Kulstof-kulstof kovalente bindinger langt mere fleksible end antagetMolekylerne syntetiseret og analyseret af forskergruppen. I grøn og blå er den fleksible C-C enkeltbinding (Takuya Shimajiri, Takanori Suzuki, Yusuke Ishigaki, Angewandte Chemie International Edition,
Kulstof-kulstof kovalente bindinger langt mere fleksible end antagetMolekylerne syntetiseret og analyseret af forskergruppen. I grøn og blå er den fleksible C-C enkeltbinding (Takuya Shimajiri, Takanori Suzuki, Yusuke Ishigaki, Angewandte Chemie International Edition, -
 Nye metamaterialer omdannes til nye former, overtager nye ejendommeEt nanoarchitected metamateriale deformerer for at oprette Caltech -ikonet. Kredit:Julia Greer/Caltech En nyudviklet type arkitekteret metamateriale har evnen til at ændre form på en afstemt måde.
Nye metamaterialer omdannes til nye former, overtager nye ejendommeEt nanoarchitected metamateriale deformerer for at oprette Caltech -ikonet. Kredit:Julia Greer/Caltech En nyudviklet type arkitekteret metamateriale har evnen til at ændre form på en afstemt måde. -
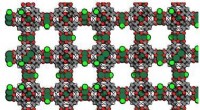 Tamning af defekte porøse materialer til robust og selektiv heterogen katalyseRepræsentation af (Ru) HKUST-1 MOF. Kredit:Manuel A. Ortuño Produktionen af 1-buten via ethylen-dimerisering er en af de få industrielle processer, der anvender homogen katalyse på grund af de
Tamning af defekte porøse materialer til robust og selektiv heterogen katalyseRepræsentation af (Ru) HKUST-1 MOF. Kredit:Manuel A. Ortuño Produktionen af 1-buten via ethylen-dimerisering er en af de få industrielle processer, der anvender homogen katalyse på grund af de
- Farmaceutisk materiale viser løfte om bedre batterier i netskala
- Total fornyelse nødvendig for at sikre fremtiden for australsk turisme
- Ny isoleringsteknik baner vejen for kraftigere og mindre spåner
- Strømning i astenosfæren trækker tektoniske plader med
- Hvordan forekommer acceleration?
- Sådan lagres og få adgang til ligninger på en TI-83 Plus


